1、选择题 有四种混合溶液,分别由等体积0.1mol·L-1的2种溶液混合而成:①CH3COONa与HCl;②CH3COONa与
NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3。下列关于该四种混合溶液的各项排序正确的是
[? ]
A.pH:②>③>④>①
B.c(CH3COO-):②>④>③>①
C.c(H+):①>③>②>④
D.c(CH3COOH):①>④>③>②
参考答案:B
本题解析:
本题难度:一般
2、填空题 现有下列电解质溶液:① Na2CO3 ② NaHCO3 ③? ④CH3COONH4 ⑤NH4HCO3
④CH3COONH4 ⑤NH4HCO3
已知酸性H2CO3 >?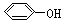 > HCO3-
> HCO3-
(1)常温下,物质的量浓度相同的① 、②、③溶液pH大小顺序为(填写序号):_____>_____>_____。
(2)写出⑤与足量NaOH溶液混合加热反应的离子方程式____________________。
(3)已知常温下CH3COONH4溶液呈中性,根据这一事实推测⑤溶液的pH_____7(填>、=或<)
(4)在温度t ℃时,pH=3的某水溶液中c(OH-)=10-9 mol/L在此温度下pH均为4的盐酸和(NH4)2SO4溶液中由水电离出的c(H+)之比为_________。
(5)将标准状况下的4.48 L氨气完全溶解在含0.1 mol HCl的水溶液中形成1 L溶液,所得溶液pH=9,其中离子浓度由大到小的顺序是_______________。
(6)常温下,pH=10的强碱AOH和pH=4的酸HnB等体积混合后溶液显酸性, AOH与HnB完全中和所得溶液呈_________性,其原因用离子方程式表示为__________________________。
参考答案:(1)①>③>②
(2)NH4++HCO3-+2OH- NH3↑+CO32-+2H2O
NH3↑+CO32-+2H2O
(3)>
(4)1:104
(5)c(NH4+)>c(Cl-)>c(OH-)>c(H+)?
(6)碱;Bn-+H2O HBn-1+OH-
HBn-1+OH-
本题解析:
本题难度:一般
3、选择题 下列物质的稀溶液中,溶质的阴、阳离子个数之比为1:2的是( ? )
A.Na2HPO4
B.NaHSO4
C.(NH4)2SO4
D.K2S
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列物质导电性能最差的是
A.熔融的氢氧化钠
B.石墨棒
C.盐酸溶液
D.固态氯化钾
参考答案:D
本题解析:物质导电的实质就是带电粒子的定向移动,即一要有带电粒子,二要带电粒子可自由移动,固态氯化钾中虽有带电粒子,但不能自由移动,所以不能导电.
本题难度:简单
5、填空题 (8分)某澄清溶液,可能含有NH4+ 、Na+、K+、Cl-、CO32-、SO42-中的一种或几种,现做如下实验:
、Na+、K+、Cl-、CO32-、SO42-中的一种或几种,现做如下实验:
①取少量该溶液加入BaC l2溶液有白色沉淀生成,再加入足量盐酸后,沉淀部分溶解,并有气体生成。
l2溶液有白色沉淀生成,再加入足量盐酸后,沉淀部分溶解,并有气体生成。
②用铂丝蘸取少量该溶液置于无色酒精灯火焰中灼烧,火焰呈黄色,透过蓝色钴玻璃观察,未见紫色火焰。
③另取少量该溶液加入NaOH溶液并加热,将湿润的红色石蕊试纸靠近试管口无颜色变化。
(1)第①步可以检验出的离子是 ? ?
(2)第②③步说明一定含有的离子是 ?
(3)从以上操作中,不能判断是否存在的离子是 ,为了检验该离子是否存在,请你写出进一步检验的 操作步骤和实验现象:
操作步骤和实验现象:
参考答案:(8分)
(1) CO32-? SO42- ?
(2) Na+?
(3) Cl- ,加硝酸酸化的AgNO3,有白色沉淀
本题解析:略
本题难度:一般