1、选择题 将18g铜和铁的混合物投入200mL稀硝酸中,充分反应后得到标准状况下2.24LNO,剩余9.6g金属;继续加入200mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下2.24LNO.若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法正确的是( )
A.原混合物中铜和铁各0.15mol
B.稀硝酸的物质的量浓度为1mol/L
C.第一次剩余的9.6g金属为铜和铁
D.再加入上述200mL稀硝酸,又得到标准状况下2.24LNO
参考答案:溶液不变红,即反应是恰好完全反应,既没有三价铁离子,也没有硝酸剩余.可以看作是18g混合物质与400ml硝酸反应生成0.2mol NO.铁铜全都生成二价的离子,设铁为A mol,铜为Bmol,发生的反应离子方程式为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;列两个方程:
56A+64B=18、2A/3+2B/3=0.2.
解得:A=0.15mol、B=0.15mol? 计算得到18g混合物中含铁质量为0.15mol×56g/mol=8.4g;
含铜质量为0.15mol×64g/mol=9.6g;
A、原混合物中铜和铁各0.15mol,故A正确;
B、硝酸浓度为:C(HNO3)=0.8mol/0.4L=2mol/L;稀硝酸的物质的量浓度为2mol/L,故B错误;
C、第一次剩余金属9.6g,通过上述计算得到为铜,故C错误;
D、溶液中二价铁离子为0.15mol,所以再加硝酸得NO为0.05mol即11.2L,故D错误;
故选A.
本题解析:
本题难度:一般
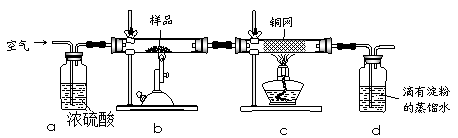
2、实验题 黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
 ?
?
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
(1)称量样品所用的仪器为?(填“托盘天平”或“电子天平”),将样品研细后再反应,其目的是?。
(2)装置a和c的作用分别是?和?(填标号)。
a.除去SO2气体
b.除去空气中的水蒸气
c.有利于气体混合
d.有利于观察空气流速
e.除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是?。
(4)通过计算可知,该黄铜矿的纯度为?。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是?(填序号)。
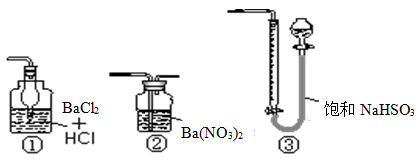
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有?。
参考答案:(1)电子天平,使原料充分反应、加快反应速率。
(2)b、d和e
(3)使反应生成的SO2全部进入d装置中,使结果精确。
(4)80%
(5)②。
(6)空气中的CO2与Ba(OH)2反应生成BaCO3沉淀;BaSO3被氧化成BaSO4
本题解析:(1)托盘天平的精确度为 0.1g,故只有电子天平才能称取1.150g样品;研细的目的是增大固体的表面积,使原料充分反应、加快反应速率;
(2)浓硫酸能除去空气中的水蒸气,且洗气瓶有利于观察空气流速;灼热铜网的目的是除去反应后多余的氧气;
(3)反应结束后,装置中还有SO2,所以仍需通入一段时间的空气,其目的是使反应生成的SO2全部进入d装置中,使结果精确;
(4)由c?V可知n(I2)=0.05mol/L×20.00×10-3L,由I2+SO2+2H2O=4H++2I-+SO42-可知n(SO2)=n(I2)=0.05mol/L×20.00×10-3L,则总的n(SO2)=0.05mol/L×20.00×10-3L÷1/10,由CuFeS2~2SO2可知,n(CuFeS2)=0.05mol/L×20.00×10-3L÷1/10÷2,由n?M可知m(CuFeS2)=0.05mol/L×20.00×10-3L÷1/10÷2×184g/mol,则其纯度为0.05mol/L×20.00×10-3L÷1/10÷2×184g/mol÷1.150g×100%=80%;
(5)SO2不能与BaCl2反应,故①错误;SO2与Ba(NO3)2溶液反应,生成白色的硫酸钡沉淀,过滤、干燥、称取沉淀的质量,可以测定样品的纯度,故②正确;SO2不能与NaHSO3溶液反应,故③错误;
(6)空气中的CO2与Ba(OH)2反应生成BaCO3沉淀,BaSO3被氧化成BaSO4,这些因素都可能导致误差
本题难度:一般
3、判断题 (15分)已知A为常见的金属单质,根据下图所示的关系:
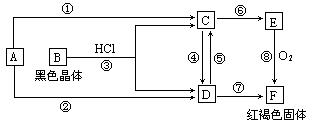
(1)确定A、B的化学式,A为 __________,B为 ___________。
(2)C和D可相互转化,描述C→D溶液的颜色变化:____________________。
④的离子方程式:_____________________________________________________。
⑤的离子方程式:_____________________________________________________。
(3)由E→F的实验现象为:___________________________________。
写出⑧的化学方程式:___________________________________________________。
参考答案:(1)Fe(2分)? Fe3O4(2分)
(2)溶液由浅绿色到黄色(或描述成深黄、黄褐、棕黄也可)(2分)
④:Fe+2Fe3+══3Fe2+(2分,其它合理也可)
⑤:2Fe2+ + Cl2══2Fe3++2Cl-(2分,其它合理也可)
(3)沉淀由白色很快变为灰绿色,最后变为红褐色(2分)
4Fe(OH)2 + O2 + 2H2O══4Fe(OH)3(3分)
本题解析:(中难)考查铁及其化合物综合应用能力,同时考查分析判断与逻辑推理能力。从最初条件看,框图很模糊,直接得不出结论,但找到“题眼”——“红褐色固体F”,就可迅速得出F是Fe(OH)3。从而得出A为Fe,“ 黑色晶体”B为Fe3O4,继而推出C为FeSO4,D为Fe2(SO4)3,E为Fe(OH)2。技能空间:化学框图题综合性强,难度大,解题时常由于知识的综合性不够,找不到“突破口”而无法下手。在学习时要注重培养知识的全面性、系统性。本题涉及的各个反应都是应该掌握的,现归纳如下:
反应①:Fe+ 2HCl══FeCl2+H2↑
反应②:2Fe+3Cl2══2FeCl3
反应③:Fe3O4+8HCl══FeCl2+2FeCl3+4H2O
反应④:2FeCl2+ Cl2══2FeCl3
反应⑤:Fe+2FeCl3══3FeCl2
反应⑥:FeCl2 + 2NaOH══Fe(OH)2+ 2NaCl
反应⑦:FeCl3 + 3NaOH══ Fe(OH)3
反应⑧:4Fe(OH)2 + O2 + 2H2O══4Fe(OH)3
应试策略:铁及其化合物相互转化问题是化学框图题中常考内容,在金属中铁是最重要的内容,熟练掌握铁及其化合物相互转化关系以及氧化还原、盐类水解等相关知识是解答此类题目的关键。铁元素及其化合物的推断题的解题一般思路:一是寻找特征反应及特征现象,二是正确运用“铁三角”的转化关系,三是注意与其它金属及其化合物知识的综合。
本题难度:一般
4、简答题 试样X由氧化亚铁和氧化铜组成.取质量相等的两份试样按下图所示进行实验:
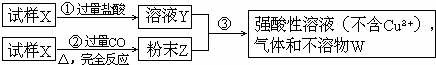
(1)请写出步骤③中所发生的全部反应的离子方程式.
(2)若全部的溶液Y和全部的粉末Z充分反应后,生成的不溶物W的质量是m,则每份试样X中氧化铜的质量为______.(用m表示)
参考答案:(1)因为CuO+CO?加热?.?Cu+CO2,FeO+CO?加热?.?Fe+CO2,所以固体粉末Z为Cu和Fe.铁能和铜离子发生置换反应,所以铁和铜离子发生的离子方程式为:Fe+Cu2+=Cu+Fe2+;强酸性溶液E不含铜离子,且有气体F生成,所以铁与铜离子反应铁过量,铁还和酸反应,所以铁和酸反应的离子方程式为:Fe+2H+=Fe2++H2↑;
答:步骤③中所发生的全部反应的离子方程式为Fe+Cu2+=Cu+Fe2+、Fe+2H+=Fe2++H2↑;
(2)不溶物W为铜,铜有两部分来源,一部分是CO还原出的铜,一部分为铁与铜离子反应置换出的铜,所以以W的一半计算试样中的氧化铜的质量;
? CuO--Cu
? 80g? 64g
?54?m? ?m
所以试样中氧化铜的质量为?54?m×12=58m,故答案为:58m.
本题解析:
本题难度:一般
5、选择题 常温下,不能用铁制容器存放的物质是
A.浓硫酸
B.浓硝酸
C.CuSO4溶液
D.稀氨水
参考答案:C
本题解析:浓硫酸、浓硝酸都可以使铁制容器发生钝化能用铁制容器存放,A、B不选;
CuSO4+Fe=" Fe" SO4+ Cu?,CuSO4溶液不能用铁制容器存放,稀氨水不与铁反应可用铁制容器存放。答案选C.
本题难度:简单