1、选择题 下列说法正确的是(?)
A.滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,原溶液中一定无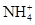
B.向装有Fe(NO3)2溶液的试管中加入稀H2SO4,可在管口观察到红棕色气体
C.过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液,溶液呈红色
D.46 g NO2和N2O4混合气体中含有原子总数为3NA,含有的分子总数为NA
参考答案:B
本题解析:由于氨气极易溶于水,若铵盐和强碱在稀溶液中反应且不加热时,产生的氨气不会挥发出来,红色石蕊试纸就不会变蓝色,A错;在酸性溶液中 具有氧化性,被Fe2+还原成NO气体,NO气体在管口遇空气氧化成NO2,B正确;Fe粉与稀硝酸反应生成物是Fe3+,但过量的铁会继续和Fe3+反应,将其还原成Fe2+,所以滴入KSCN溶液不可能显红色,C错;假设46 g气体全为NO2,则其含有的原子数为3NA,含有的分子数为NA,实际存在反应2NO2(g)
具有氧化性,被Fe2+还原成NO气体,NO气体在管口遇空气氧化成NO2,B正确;Fe粉与稀硝酸反应生成物是Fe3+,但过量的铁会继续和Fe3+反应,将其还原成Fe2+,所以滴入KSCN溶液不可能显红色,C错;假设46 g气体全为NO2,则其含有的原子数为3NA,含有的分子数为NA,实际存在反应2NO2(g)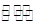 ?N2O4(g),导致分子数减少,原子数不变,D错。
?N2O4(g),导致分子数减少,原子数不变,D错。
本题难度:一般
2、选择题 通常状况下,NC13是一种油状液体,其分子空间构型与氨分子相似,下列对NC13的有关叙述正确的是
A.分子中N—C1键键长比CCl4分子中C—C1键键长长
B.分子中的所有原子均达到8电子稳定结构
C.NCl3分子是非极性分子
D.NBr3比NCl3易挥发
参考答案:B
本题解析:A错,.分子中N—C1键键长比CCl4分子中C—C1键键长短;B正确;C错,.NCl3分子是极性分子;D错,NBr3比NCl3难挥发,它的沸点相对更高;
本题难度:一般
3、计算题 40 mL NO2、NO混合气体,通入20 mL O2并用排水法收集,得到5 mL无色气体(均在同温同压下测得),求NO2的体积。
参考答案:30 mL或12.5 mLs
本题解析:根据4NO2+O2+2H2O====4HNO3和4NO+3O2+2H2O====4HNO3,若40 mL全是NO2,则O2过量,若40 mL全是NO,则O2不足,最后收集到的5 mL气体可能是未反应的NO,也可能是过量的氧气,故本题需分两种情况计算。
(1)O2过量:设NO2体积为x,NO为40 mL-x。
4NO2+O2+2H2O====4HNO3
4? 1
x?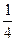 x
x
4NO? +? 3O2+2H2O====4HNO3
4? 3
40 mL-x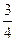 (40 mL-x)
(40 mL-x)
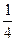 x+
x+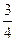 (40 mL-x)+5 mL="20" mL
(40 mL-x)+5 mL="20" mL
x="30" mL
(2)O2不足:设与NO2反应的O2体积为x。
4NO2+O2+2H2O====4HNO3
4? 1
4x? x
4NO? +? 3O2+2H2O====4HNO3
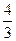 (20 mL-x)20 mL-x
(20 mL-x)20 mL-x
4x+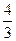 (20 mL-x)+5 mL="40" mL
(20 mL-x)+5 mL="40" mL
x="3.125" mL
V(NO2)=4×3.125 mL="12.5" mL
本题难度:简单
4、选择题 常温下,将盛有10 mL NO2、10 mL NO混合气体的试管倒置在水中,并向其中通入氧气,一段时间后试管内尚余2 mL O2,则通入氧气的体积为(?)
A.7.5 mL
B.8.5 mL
C.10 mL
D.12 mL
参考答案:D
本题解析:略
本题难度:简单
5、选择题 在铁与铜的混和物中,加入一定量的稀硝酸,充分反应后剩余金属m1g,再向其中加入一定量的稀硫酸,充分振荡后,剩余金属m2g,m1与m2的关系是
A.m1 g固体中一定有铁
B.m1一定大于m2
C.m1可能等于m2
D.m1可能大于m2
参考答案:B
本题解析:铁、铜均可溶于稀硝酸生成硝酸盐,充分反应后剩余金属时,再加入一定量的稀硫酸,可提供氢离子,结合溶液中的硝酸根离子,可继续氧化金属,故m1一定大于m2
本题难度:一般