1、选择题 NH4H与NH4Cl相似,与水可以反应生成H2,以下说法正确的是(?)
A.H-半径比Li+半径小
B.NH4H与水反应生成两种可燃性气体
C.NH4H是离子化合物
D.NH4H的水溶液呈酸性
参考答案:C
本题解析:由题目所给信息:NH4H+H2O====NH3·H2O+H2↑,且NH4Cl是离子化合物,故B、D均不正确;由于H-与Li+核外电子层结构相同,但H-核电荷数比Li+小,所以H-半径比Li+半径大。
本题难度:简单
2、实验题 (共10分)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,反应方程式为2NH3+3CuO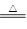 N2+3H2O+3Cu,用示意图中的装置可以实现该反应。回答下列问题:
N2+3H2O+3Cu,用示意图中的装置可以实现该反应。回答下列问题:
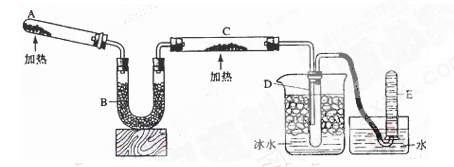
(1)A中发生反应的化学方程式是?。检验氨气通常采用的方法及现象是_________?______,?。
(2)B中加入的物质是?,其作用是?。
(3)实验时C中观察到的现象是?,该反应中氨的作用是_______剂。
(4)若要检验反应生成的水,可将试管D及烧杯部分改成两个相连的干燥管,第一个干燥管X内装有_____________,现象是___________________;第二个干燥管Y内装有碱石灰,作用是____________________________。
参考答案:(1)2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O (1分)
2NH3↑+CaCl2+2H2O (1分)
用湿润的红色石蕊试纸(1分),试纸变蓝(1分)
(2)碱石灰,(1分)除去氨水中的水蒸汽(1分)
(3)黑色固体逐渐变成红色(1分),还原(1分)
(4)无水硫酸铜(1分),变蓝(1分)
防止E中的水蒸汽进入干燥管x,影响水的检验。(1分)
本题解析:(1)A中是制取氨气的,所以方程式为2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O。氨气溶于水显碱性,和氯化氢反应冒白烟,据此可以检验。
2NH3↑+CaCl2+2H2O。氨气溶于水显碱性,和氯化氢反应冒白烟,据此可以检验。
(2)和氧化铜反应的氨气应该是干燥的,所以B中用碱石灰除去氨气中的水蒸气。
(3)氨气具有还原性,在加热的条件下,能还原氧化铜,生成铜、氮气和水,所以现象是黑色固体逐渐变成红色。
(4)检验水蒸气常用无水硫酸铜,遇水即变成蓝色。用于装置E中水蒸气可能进入干燥管。影响水的检验,所以作用就是防止E中的水蒸汽进入干燥管x,影响水的检验。
本题难度:一般
3、选择题 下列叙述不正确的是
A.NH3易液化,液氨常用作制冷剂
B.与铜反应时,浓硝酸被还原成NO2而稀HNO3被还原成NO,所以稀HNO3氧化性强于浓HNO3
C.氨盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处
D.氨水逐滴滴加到硝酸银溶液中,先出现沉淀,后沉淀溶解
参考答案:B
本题解析:与金属反应时,稀HNO3被还原为NO,反应缓慢,浓HNO3被还原为NO2,反应剧烈,所以稀HNO3的氧化性弱于浓HNO3,故B错误。
本题难度:一般
4、填空题 (12分)X、Y、Z、W为常见含有相同电子数的离子或分子,其中X有5个原子核,这些微粒与一氧化氮间有如下转化关系(图中部分反应物、产物及反应条件已略去)。
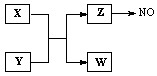
(1)Z →NO反应的化学方程式是:?
液态 Z与水的电离相似,其中存在的电子数相同的两种微粒是?。
(2)实验室中检验Z的化学试剂及现象是:
(3)由构成X、Y的三种元素所组成的一种离子化合物,且三种元素原子数之比为2:4:3,该离子化合物是?(填写化学式)。
(4)一定条件下,Z与一氧化氮或二氧化氮反应均可生成两种很稳定的产物。若有二氧化氮与Z的混合气体20 mL在该条件下反应,实际参加反应的二氧化氮比Z少2 mL,则原混合气体中Z与二氧化氮的体积比是?。
参考答案:(12分)
(1) ? NH2—、NH4+
? NH2—、NH4+
(2)
?
?化学试剂
?现象
方法一
用湿润的红色石蕊试纸检验(1分)
试纸变为蓝色(1分)
方法二
蘸有浓盐酸的玻璃棒检验(1分)
有白烟生成(1分)
(3)NH4NO3;
(4)2﹕3或7:3
本题解析:本题主要考查了微粒结构、氨气的性质及检验;氧化还原反应的相关知识;
(1)联想常见的10电子微粒,再依题意很容易知道:X为NH4+、Y为OH—、Z为NH3、W为H2O;
(4)4NH3 + 3NO2 =2N2 + 6H2O
设参加反应的NH3为a ml,则参加反应的NO2为3a/4,即a-3a/4=2,a=8。
所以参加反应的NH3为8 ml,NO2为6ml;由于二者共20 ml,很容易算出
NH3过量:NH3为14 ml,NO2为6 ml,二者体积比为7:3
NO2过量:NH3为8 ml,NO2为12 ml,二者体积比为2:3
本题难度:一般
5、计算题 现有N2、NH3、NO2组成的混合气体10L.此混合气体通过稀H2SO4时,溶液增重12.5g,混合气体体积减少到3.28L(体积均在标准状况下测定),则此混合气体中三种成分的体积分别是多少?
参考答案:
此混合气体中N2有1.04升,NH3有2.24升,NO2有6.72升。
本题解析:
据题意,混合气体通过稀H2SO4时的反应为:2NH3+H2SO4=(NH4)2SO4?
混合气中的NH3留在溶液中,增加了质量,并使混合气的体积缩小.同时3NO2+H2O=2HNO3+NO也使溶液增加了质量和气体体积缩小了,生成的NO气的体积是混合气中NO2体积的1/3.通过稀硫酸后的气体是原混合气中的N2和新生成的NO气的混合气体。
稀硫酸溶液质量的增加量是原混合气中NH3的量和NO2跟水反应与生成NO的质量差。
设:原混合气中的NO2为xL,NH3为yL,则N2为(10-x-y)L。
根据题意,可到方程组:
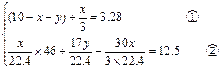 ?
?
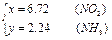
本题难度:简单