|
高考化学知识点整理《离子方程式的书写及正误判断》答题技巧(2020年最新版)(六)
2021-06-11 05:36:18
【 大 中 小】
|
1、选择题 下列反应的离子方程式正确的是( )
A.氨气通入醋酸溶液 CH3COOH+NH3 ="=" CH3COONH4
B.澄清的石灰水跟盐酸反应 Hcl+OH- ="=" H2O+cl-
C.碳酸钙溶于醋酸 CaCO3+2H+ ="=" Ca2++H2O+CO2↑
D.金属钠跟水反应 2Na+2H2O ="=" 2Na++2OH-+H2↑
|
参考答案:D
本题解析:
正确答案:D
A、CH3COOH+NH3 = CH3COO
本题难度:一般
2、填空题 (12分)钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。
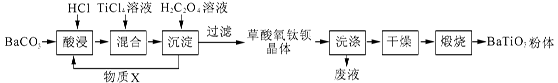
(1)酸浸时发生的反应的离子方程式为 ;为提高BaCO3的酸浸率,可采取的措施为 (任答一点)。
(2)配制TiCl4溶液时,通常将TiCl4溶于浓盐酸,目的是 。
(3)加入H2C2O4溶液时,发生反应的化学方程式为 ;
可循环使用的物质X是 。
(4)煅烧得到BaTiO3的同时,生成高温下的气体产物有CO、 和 。
参考答案:(1)BaCO3+2H+ = Ba2+ + CO2↑+H2O; 将BaCO3粉碎 (2)抑制TiCl4的水解
(3)BaCl2 + TiCl4 + 2H2C2O4 + 5H2O = BaTiO(C2O4)2·4H2O↓+ 6HCl; 盐酸(或HCl)(各2分)
(4)CO2、H2O(g) (各1分)
本题解析:(1)BaCO3不能溶于水,但是可以溶于酸,与酸发生反应产生CO2,反应的方程式是:BaCO3+2H+ = Ba2+ + CO2↑+H2O;BaCO3是固体物质,为提高BaCO3的酸浸率,可采取的措施为将BaCO3粉碎或适当提高盐酸的浓度、升高反应温度等;(2)TiCl4是强酸弱碱盐,在溶液中Ti4+容易发生水解反应使溶液显酸性,产生Ti(OH)4会使溶液变浑浊,为了抑制盐的水解,配制TiCl4溶液时,通常将TiCl4溶于浓盐酸,然后再加水稀释;(3)向含有BaCl2、HCl、TiCl4的溶液加入H2C2O4溶液时,发生反应的化学方程式为BaCl2 + TiCl4 + 2H2C2O4 + 5H2O = BaTiO(C2O4)2·4H2O↓+ 6HCl;根据反应的物质及反应产生的物质可知,可循环使用的物质X是盐酸;(4)草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O]煅烧,可得到BaTiO3、CO2、H2O(g)。
考点:考查化学反应的离子方程式、化学方程式的书写、影响化学反应速率的因素、反应条件的控制、物质反应产物的成分的确定的知识。
本题难度:一般
3、填空题 22、写出下列物质反应的离子方程式为
(1)HCl与Na2CO3:____________ ____________;
(2)HCl与AgNO3:____________ ______________。
参考答案:(1)2H++ CO32-= H2O+CO2↑
(2)Cl-+Ag+= AgCl↓
本题解析:(1)写:2HCl+ Na2CO3="2" NaCl+H2O+CO2↑
改:2H++2Cl-+Na++CO32-=2Na++2Cl-+H2O+CO2↑
那么离子方程式为2H++ CO32-= H2O+CO2↑
(2)写: HCl+ AgNO3=AgCl↓+HNO3
改: H++Cl-+Ag++NO3-= AgCl↓+H+NO3-
那么离子方程式为Cl-+Ag+= AgCl↓
考点:离子方程式的书写
点评:本题注意离子方程式的书写步骤,要注意电荷守恒和原子守恒。
本题难度:一般
4、填空题 (选做题12分)
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeC03的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeC03固体。
参考答案:
本题解析:
本题难度:困难
5、填空题 (8分)向Ba(OH)2溶液中逐滴加入稀硫酸.请完成下列问题:
(1)写出反应的离子方程式__________________________________________________
(2)下列三种情况下,离子方程式与(1)相同的是________(填序号).
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO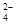 恰好完全沉淀 恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
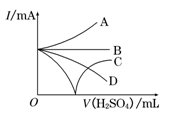
(3)若缓缓加入稀H2SO4直至过量,整个过程中混合溶液中的导电能力(用电流强度I表示)可近似地用右图中的曲线表示是________(填序号).
(4)若向装有Ba(OH)2溶液烧杯里缓缓滴入KAl(SO4)2溶液至Ba2+恰好完全反应.则反应的离子方程式是 _________________________________.
参考答案:(1)Ba2++2OH-+2H++SO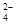 ===BaSO4↓+2H2O (2)A (3)C ===BaSO4↓+2H2O (2)A (3)C
(4)2Ba2++4OH-+Al3++2SO42-=2BaSO4↓ + AlO2-+2H2O
本题解析:(1)Ba(OH)2溶液中逐滴加入与稀硫酸反应的离子方程式是Ba2++2OH-+2H++SO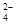 ===BaSO4↓+2H2O;(2) A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性,离子方程式是Ba2++2OH-+2H++SO ===BaSO4↓+2H2O;(2) A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性,离子方程式是Ba2++2OH-+2H++SO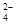 ===BaSO4↓+2H2O;相同,正确;B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO ===BaSO4↓+2H2O;相同,正确;B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO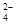 恰好完全沉淀,应该以NaHSO4为标准,离子方程式是:Ba2++OH-+H++SO 恰好完全沉淀,应该以NaHSO4为标准,离子方程式是:Ba2++OH-+H++SO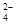 ===BaSO4↓+H2O,不相同,错误;C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量,应该以NaHSO4为标准离子方程式是Ba2++OH-+H++SO ===BaSO4↓+H2O,不相同,错误;C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量,应该以NaHSO4为标准离子方程式是Ba2++OH-+H++SO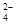 ===BaSO4↓+H2O,不相同,错误;(3) 向Ba(OH)2溶液中逐滴加入稀硫酸,由于发生反应:Ba2++2OH-+2H++SO ===BaSO4↓+H2O,不相同,错误;(3) 向Ba(OH)2溶液中逐滴加入稀硫酸,由于发生反应:Ba2++2OH-+2H++SO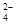 ===BaSO4↓+2H2O,溶液中自由移动的离子浓度逐渐减小,所以溶液的导电性逐渐减弱,当Ba(OH)2恰好完全时,由于BaSO4是难溶的强电解质,水是弱电解质,溶液中离子的浓度几乎为0,所以导电能力最小,此后随着硫酸的滴加,溶液中硫酸电离产生的离子浓度逐渐增大,溶液的导电性又逐渐增强,因此整个过程中混合溶液中的导电能力的曲线表示是C;(4)若向装有Ba(OH)2溶液烧杯里缓缓滴入KAl(SO4)2溶液至Ba2+恰好完全反应.此时由于Al3+与OH-的个数比是1:4,所以Al元素的存在形式是AlO2-,则反应的离子方程式是2Ba2++4OH-+Al3++2SO42-=2BaSO4↓ + AlO2-+2H2O。 ===BaSO4↓+2H2O,溶液中自由移动的离子浓度逐渐减小,所以溶液的导电性逐渐减弱,当Ba(OH)2恰好完全时,由于BaSO4是难溶的强电解质,水是弱电解质,溶液中离子的浓度几乎为0,所以导电能力最小,此后随着硫酸的滴加,溶液中硫酸电离产生的离子浓度逐渐增大,溶液的导电性又逐渐增强,因此整个过程中混合溶液中的导电能力的曲线表示是C;(4)若向装有Ba(OH)2溶液烧杯里缓缓滴入KAl(SO4)2溶液至Ba2+恰好完全反应.此时由于Al3+与OH-的个数比是1:4,所以Al元素的存在形式是AlO2-,则反应的离子方程式是2Ba2++4OH-+Al3++2SO42-=2BaSO4↓ + AlO2-+2H2O。
考点:考查溶液中离子方程式的书写、比较及溶液的导电性变化的知识。
本题难度:一般
|