1、选择题 工业上制备纯硅反应的化学方程式为SiCl4(g)?+?2H2(g) Si(s)?+?4HCl(g)?△H>0,下列措施能提高反应速率且使平衡向正反应方向移动的是
Si(s)?+?4HCl(g)?△H>0,下列措施能提高反应速率且使平衡向正反应方向移动的是
[? ]
A.升温?
B.加压?
C.减压?
D.加催化剂?
2、简答题 下面的装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫.

请回答下列问题:
(1)写出沸腾炉内煅烧黄铁矿的化学方程式______;
(2)上图中的乙、丙分别相当于工业上制取硫酸设备中的______、______;
(3)丁中的现象为______;
(4)下图是压强对SO2平衡转化率的影响:
| 转化率%? 压强/MPa? 温度/℃ | 0.1 | 0.5 | 1 | 10
400
99.2
99.6
99.7
99.9
500
93.5
96.9
97.8
99.3
600
73.7
85.8
89.5
96.4
|
对SO2转化为SO3的反应,增大压强可使转化率______,工业生产中通常采用常压操作的原因是______.
3、选择题 某同学在三个容积相同的密闭容器中,分别研究三种不同条件下化学反应2X(g)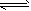 Y(g)+W(g)的进行情况。其中实验I、Ⅱ控温在T1,实验Ⅲ控温在T2,它们的起始浓度均是c(X)=1.0 mol/L,c(Y) =c(W)=0,测得反应物X的浓度随时间的变化如图所示。下列说法不正确的是
Y(g)+W(g)的进行情况。其中实验I、Ⅱ控温在T1,实验Ⅲ控温在T2,它们的起始浓度均是c(X)=1.0 mol/L,c(Y) =c(W)=0,测得反应物X的浓度随时间的变化如图所示。下列说法不正确的是

[? ]
A.与实验I相比,实验Ⅱ可能使用了催化剂
B.与实验I相比,实验Ⅲ若只改变温度,则温度T1<T2,该反应是吸热反应
C.在实验I、Ⅱ、Ⅲ中,达到平衡状态时X的体积百分含量相同
D.若起始浓度c(X) =0.8 mol/L,c(Y)=c(W)=0,其余条件与实验I相同,则平衡浓度c(X) =0.4 mol/L
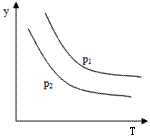
4、选择题 反应:L(s)+aG(g) bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断
bR(g) 达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断
[? ]
A.上述反应是放热反应
B.上述反应是吸热反应
C.a>b
D.无法判断a,b大小
5、选择题 对可逆反应4NH3(g)+ 5O2(g)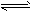 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
[? ]
A.达到化学平衡时,4v正(O2)= 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)= 3v正(H2O)