1、选择题 下列操作会使H2O的电离平衡向正方向移动,且所得溶液呈酸性的是
A.向水中加入少量的HCl
B.向水中加入少量的NaOH
C.向水中加入NaCl并加热至100℃,pH="6"
D.向水中加少量的NH4Cl
参考答案:D
本题解析:略
本题难度:简单
2、简答题 恒温下,将16molN2与bmolH2的混合气体通入一个固体容积的密闭容器中,发生如下反应:N2(g)+3H2(g)?2NH3(g)
(1)若反应进行到某时刻t时,nt(H2)=15mol,nt(NH3)=6mol,则b的值为______.
(2)反应达到平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%.计算平衡时:
①原混合气体与平衡混合气体的总物质的量之比______(写出最简整数比,下同)
②达到平衡时,N2和H2的转化率之比a(N2):a(H2)______
③平衡混合气体中,n(N2):n(H2):n(NH3)______.
参考答案:(1)根据方程式计算:
N2(g)+3H2(g)?2NH3(g)
起始(mol):16molb 0
转化(mol):3mol9mol 6mol
t时刻(mol):15mol6mol
所以b-9=15,则b=24,
故答案为:24;
(2)反应达平衡时,混合气体为716.8L22.4L/mol=32mol,其中NH3的物质的量为32mol×25%=8mol,
①利用差量法计算:
N2 (g)+3H2(g)?2NH3(g),物质的量减少△n
1mol 3mol 2mol 2mol
转化:4mol 12mol 8mol 8mol
故原混合气体为:32mol+8mol=40mol,
则原混合气体与平衡混合气体的物质的量之比n(始):n(平)=40mol:32mol=5:4,
答:原混合气体与平衡混合气体的总物质的量之比为5:4;
②反应转化的氮气物质的量为4mol,转化率为:4mol16mol×100%=25%,
转化的氢气物质的量为12mol,转化率为:12mol24mol×100%=50%,
达到平衡时,N2和H2的转化率之比a(N2):a(H2)=25%:50%=1:2,
答:达到平衡时,N2和H2的转化率之比a(N2):a(H2)为1:2;
③平衡混合气的组成为:N2为16mol-4mol=12 mol,NH3为8 mol,H2为32mol-12mol-8mol=12mol,
平衡混合气体中,n(N2):n(H2):n(NH3)=12mol:12mol:8mol=3:3:2,
答:平衡混合气体中,n(N2):n(H2):n(NH3)为3:3:2.
本题解析:
本题难度:一般
3、填空题 (1)在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);

下列说法正确的是?(填序号);
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)= ?mol·L-1·min-1
?mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时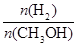 增大
增大
(2)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为?。
参考答案:(1)③④?(2)1-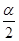
本题解析:(1)根据图像中的数据可知,温度T1时生成甲醇的速率=nA/2tA mol·L-1·min-1,故①错误;读图可知,温度从T1升高到T2时,甲醇的物质的量降低,说明平衡逆向移动,故此时平衡常数减小,故②错误;因为升高温度,平衡逆向移动,故逆反应是吸热反应,所以正反应是放热反应,故③正确;因为温度从T1升高到T2时,平衡逆向移动,故氢气的物质的量增大,甲醇的物质的量减小,故n(H2)/n(CH3OH)增大,故④正确。
(2)写出方程式CO2+3H2 CH3OH+H2O,则平衡时CO2、H2、CH3OH、H2O变化的物质的量分别是α mol、3α mol、α mol、α mol,故平衡时它们的物质的量分别是(1-α) mol、(3-3α) mol、α mol、α mol,故平衡时气体的总物质的量是(4-2α) mol,所以此时的压强与起始压强之比为(4-2α)/4=(2-α)/2。
CH3OH+H2O,则平衡时CO2、H2、CH3OH、H2O变化的物质的量分别是α mol、3α mol、α mol、α mol,故平衡时它们的物质的量分别是(1-α) mol、(3-3α) mol、α mol、α mol,故平衡时气体的总物质的量是(4-2α) mol,所以此时的压强与起始压强之比为(4-2α)/4=(2-α)/2。
本题难度:一般
4、选择题 将3?摩A?和2.5?摩B?充入容积为2升的密闭容器中,发生如下反应:3A(气)+B(气)

nC(气)+2D(气),5分钟时反应达平衡状态,生成1摩D;?经测定,以C表示的平均反应速度为0.1摩/(升?分),下列结论中错误的是
①平衡时B?的转化率为20%?②平衡时B?的浓度为1摩/升③经计算,n值为1?④用A?表示的平衡反应速度为0.3摩/(升?分)( )
A.①、②
B.①、④
C.②、③
D.③、④
参考答案:①、5分钟时反应达平衡状态,生成1molD,根据方程式3A(气)+B(气)

nC(气)+2D(气)可知,参加反应的B的物质的量为1mol×12=0.5mol,故B的转化率为0.5mol2.5mol×100%=20%,故①正确;
②、平衡时B的物质的量为2.5mol-0.5mol=2mol,故B的平衡浓度为2mol2L=1mol/L,故②正确;
③、C表示的平均反应速度为0.1mol/(L?min),故生成的C的物质的量为0.1mol/(L?min)×5min×2L=1mol,物质的量之比等于化学计量数之比,故1mol:1mol=n:2,解得n=2,故③错误;
④、速率之比等于化学计量数之比,所以v(A)=32v(C)=32×0.1mol/(L?min)=0.15mol/(L?min),故④错误;
故选D.
本题解析:
本题难度:一般
5、选择题 在一个绝热的密闭反应器中,只发生两个反应:
a(g)+b(g)  2c(g);ΔH1<0
2c(g);ΔH1<0
x(g)+3y(g)  2z(g);ΔH2>0
2z(g);ΔH2>0
进行相关操作且达到平衡后(忽略体积改变所作的功),下列叙述错误的是
A.等容时,通入惰性气体,各反应速率不变
B.等容时,通入z气体,y的物质的量浓度增大
C.等压时,通入z气体,反应器中温度升高
D.等压时,通入惰性气体,c的物质的量不变
参考答案:D
本题解析:A、等容时,通入惰性气体,各反应混合物的浓度不变,各反应速率不变,正确;B、等容时,通入z气体,第二反应平衡向逆反应移动,y的物质的量浓度增大,正确;C、等压时,通入z气体,第二反应平衡向逆反应移动,温度升高,导致第一个反应向逆反应移动,但移动结果不会恢复到原温度,故平衡时温度升高,正确;D、等压时,通入惰性气体,体积增大,第二个反应平衡向逆反应移动,温度升高,导致第一个反应向逆反应移动,c的物质的量减小,错误。
本题难度:一般