1、选择题 amol?FeO与bmol?Cu2S投入到Cmol/L的硝酸中恰好完全反应,生成NO共消耗硝酸VL,所得澄清溶液成分可看作为Fe(NO3)3、Cu(NO3)2、H2SO4的混合液,则反应中未被还原的硝酸不可能为( ? )
A.(189a+252b)g
B.(VC-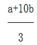 )mol
)mol
C.(3a+2b)×63g
D.(3a+4b)mol
参考答案:C
本题解析:
本题难度:简单
2、选择题 根据反应:2H2S+O2=2S↓+2H2O、4NaI+O2+2H2SO4=2I2+2Na2SO4+2H2O ?Na2S+I2=2NaI+S↓,判断下列物质的氧化性强弱,正确的是:?
A.O2>I2>S
B.H2S>NaI>H2O
C.S>I2>O2
D.H2O> H2S > NaI
参考答案:A
本题解析:试题分析:在氧化还原反应中,氧化剂的氧化性强于氧化产物的,还原剂的还原性强于还原产物的。则根据反应2H2S+O2=2S↓+2H2O可知,氧化性是O2>S;根据反应4NaI+O2+2H2SO4=2I2+2Na2SO4+2H2O可知,氧化性是O2>I2;根据反应Na2S+I2=2NaI+S↓可知氧化性是I2>S,综上所述可知,选项A正确,答案选A。
考点:考查还原性强弱的判断
点评:该题是基础性试题的考查,难度不大。主要是考查学生根据氧化还原反应判断还原性强弱的了解掌握情况,有利于培养学生的逻辑推理能力。该题的关键是准确判断出还原剂和还原产物。
本题难度:简单
3、选择题 已知在酸性条件下,下列物质氧化KI时,自身发生如下变化:如果分别用等物质的量的这些物质氧化足量的KI.得到I2的量最多的是
A.
B.
C.
D.HNO3→NO
参考答案:C
本题解析:分析:根据氧化还原反应中得失电子守恒的思想可知,在四个反应中氧化剂不一样,而还原剂均为碘化钾中的碘离子,如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的也就是比较每1mol氧化剂得电子的多少,谁得电子多谁氧化的KI多,生成的I2就多.
解答:由氧化还原反应中得失电子守恒,1mol氧化剂得电子越多,生成的I2就多;
A、1mol Cl2→2Cl-得2mol e-,
B、1mol MnO4-→Mn2+得5mol e-,
C、1mol Cr2O72-→Cr3+得6mol e-,
D、1mol HNO3→NO得3mol e-;
显然C中1mol氧化剂得电子最多,生成的I2就最多,
故选C.
点评:本题考查了氧化还原反应中电子守恒规律,明确电子守恒及转移的电子数即可解答,题目难度不大.
本题难度:简单
4、填空题 在由铜片、锌片和200?mL稀H2SO4组成的原电池中,若锌片只发生电化学腐蚀,当在铜片上放出3.36?L(标准状况)的H2时,H2SO4恰好用完,则产生这些气体消耗的Zn为____g,在导线上有____mol电子通过,原稀H2SO4的物质的量浓度是__________?mol/L。
参考答案:9.75;0.3;0.75
本题解析:
本题难度:一般
5、选择题 下列物质的用途,利用了物质的氧化性的是
A.用漂白粉消毒游泳池中的水
B.用稀盐酸除去热水瓶胆壁上的水垢(主要成分是碳酸钙)
C.用食盐腌渍食物
D.用小苏打治疗胃酸过多
参考答案:A
本题解析:漂白粉消毒利用的是生成的HClO的强氧化性,盐酸除水垢利用的是盐酸的酸性,C项利用NaCl的防腐性,D项中利用小苏打的弱碱性.
本题难度:困难