1、实验题 如下图是实验室制备SO2并验证SO2某些性质的装置图。试回答:
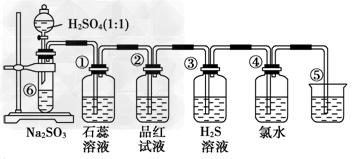
(1)⑥中发生的化学反应方程式为____________________________。
(2)⑤的作用是________________________________,反应的离子方程式为 __________________________。
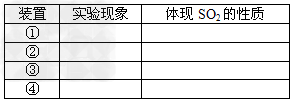
(3)填表格
参考答案:(1)Na2SO3+H2SO4===Na2SO4+H2O+SO2↑
(2)吸收过量的SO2,防?止污染环境;SO2+2OH-===SO32-+H2O
(3)
本题解析:
本题难度:一般
2、简答题 某化学兴趣小组利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气发生反应的装置.
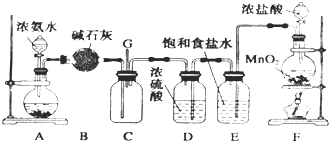
请回答下列问题:
(1)装置A中的固体物质不宜选用______(填字母编号).
a.无水氯化钙b.氢氧化钠c.氧化钙d.碱石灰e.无水硫酸铜
(2)写出装置F中发生反应的离子方程式:______;E装置的作用为______.
(3)通入C装置的两根导管左边较长、右边较短,原因是____________.
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一.当有0.15molCl2参与反应时,则生成的气体在标准状况下的体积为______.
(5)上述装置还存在一处明显的缺陷,你认为改进的措施是______.
参考答案:(1)利用物质溶解时放出的热量促进氨水的挥发来制取氨气,且该物质和氨气不反应,氨气是碱性气体,所以溶解的物质必须是碱性物质,b.氢氧化钠溶解于水时放出热量c.氧化钙和水反应生成碱且放出大量热,d.碱石灰是碱性物质,且溶于水时放热,a.无水氯化钙溶于水呈中性,且与氨气反应,e.无水硫酸铜溶于水时吸热,
故选ae;
(2)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,MnO2+4H++2C1-△.Mn2++C12↑+2H2O,E中装有饱和食盐水,食盐水中含有氯离子,能抑制氯气的溶解,装置的作用为除去氯气中混有的氯化氢,
故答案为:MnO2+4H++2C1-△.Mn2++C12↑+2H2O;除去氯气中混有的氯化氢;
(3)左边进入的为氨气,右边进入的为氯气,密度不同,则导管左边较长、右边较短使密度大的氯气与密度小的氨气较快地均匀混合,
故答案为:使密度大的氯气与密度小的氨气较快地均匀混合;
(4)C内出现浓厚的白烟为氯化铵,另一生成物是空气的主要成分之一为氮气,该反应为3Cl2+8NH3═N2+6NH4Cl,当有0.15molCl2参与反应时,
3Cl2 +8NH3 ═N2 +6NH4Cl
3mol 1mol
0.15mol n(N2)
n(N2)=0.05mol,V=n×Vm=0.05mol×22.4mol/L=1.12L,
故答案为:1.12L;
(5)氯气是有毒的气体,缺少尾气处理装置,可用碱液进行吸收,
故答案为:在G处连接一尾气处理装置;
本题解析:
本题难度:一般
3、选择题 下列所设计的四种制备气体的方案中,不宜采用的是
①加热稀硫酸和乙醇制备乙烯
②加热稀盐酸和MnO2制备氯气
③用稀硫酸和大理石制备碳酸气
④用稀硝酸和硫化亚铁制备硫化氢
A.④②
B.①②④
C.①③④
D.①②③④
参考答案:D
本题解析:
本题难度:一般
4、实验题 化学实验兴趣小组在实验室进行氢气在氯气中的燃烧实验。
(1)设计如下图所示装置I制备和收焦干燥纯净的氯气以备后续实验;
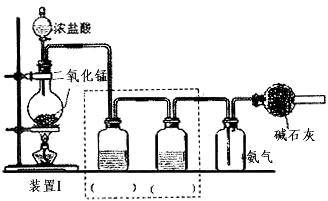
烧瓶中发生反应的离子方程式为__________________________; 请根据实验目的将装置I中虚线框内装置补充完整并在括号内注明所需试剂_____________________;
(2)在下图所示装置Ⅱ中,在试管中先加入过量铁粉,再滴入少量CaSO4溶液,最后加入一定量稀盐酸,塞上胶塞,观察到有大量气泡产生。
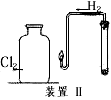
①检查制取氢气装置气密性的操作方法是____________________________
②当点燃氢后,将导管伸入盛有氯气的集气瓶中,观察到的现象是_______________________
(3)当氢气停止燃烧后,取出导管,同学们进行了分组探究实验。
①A组同学发现制氢气后的试管中还有较多固体剩余,同学们将足量氯气通入试管中,发现固体全部消失,但未观察到有气泡产生,请解释可能原因(用离子方程式表示)_______________________;
②B组同学向集气瓶中注入适量水,用力振荡后,向中满入少量Na2SO3溶液,发现溶液中没有出现黄色沉淀,但再向溶液中滴入稀盐酸酸化的氯化钡溶液后,生成了白色沉淀。[已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O],同学们分析是由于集气瓶中还有少量氯气残留的缘故。可以解释该实验现象的两个离子方程式是:________________________
参考答案:(1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)将导气管末端插入水槽中,用手握住试管,在导气管末端会有气泡产生。松开手后,导气管末端有一段水柱上升,则证明该装置的气密性良好;氢气安静地燃烧,发出苍白色火焰,瓶口出现白雾
(3)①Cl2+2Fe2+=Cl-+2Fe3+,2Fe3++Fe=3Fe2+,2Fe3++Cu=Cu2++2Fe2+,3Cl2+2Fe=2FeCl3;
②4Cl2+S2O32-+5H2O=2SO42-+8Cl-+10H+,Ba2++SO42-=BaSO4↓
本题解析:
本题难度:困难
5、简答题 (1)某化学兴趣小组的同学进行Cl2、NH3的制备、性质等实验的流程和部分装置如下:
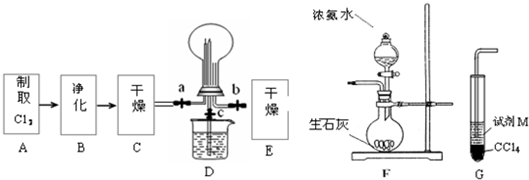
①请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2的氧化性强弱为Cl2>Fe3+>I2(实验中不断小心振荡G装置中的试管).请回答A中发生反应的离子方程式______,试剂M为______溶液,证明氧化性为Cl2>Fe3+>I2的?实验现象是______;
②已知3Cl2+2NH3=6HCl+N2,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b,D中的现象为______,反应一段时间后,关闭b打开c,观察到的现象为______;
③为使实验顺利进行,请简述F中的分液漏斗的正确操作方法______;
(2)某废水中含有一定量的Na+、SO32-,可能含有CO32-,某研究小组欲测定其中SO32-离子的浓度,设计如下实验方案:

①从下列试剂中选择试剂x为______(填序号):
A.0.1mol?L-1KMnO4(H2SO4酸化)溶液
B.0.5mol?L-11NaOH溶液
C.新制氯水
D.KI溶液
②加入试剂x生成SO42-的离子方程式为______;
③第ⅲ步的“系列操作”包含的操作名称为______、______、______;
④证明该废水中是否含有CO32-的实验方案为______.
参考答案:(1)①浓盐酸和二氧化锰在加热条件下能发生反应生成氯化锰、氯气和水MnO2+4H++2Cl-?△?.?Cl2↑+Mn2++2H2O;在D装置中,应用一个方程式判断出Cl2、Fe3+、I2的氧化性强弱,根据氧化剂的氧化性大于氧化产物的氧化性,加入碘化亚铁溶液,氯气先把碘离子氧化成碘单质,再把二价铁离子氧化成三价铁离子,所以看到的现象是:先观察到下层CCl4由无色变为紫红色,后看到上层溶液由浅绿色变为黄色.
故答案为:MnO2+4H++2Cl-?△?.?Cl2↑+Mn2++2H2O;FeI2;先观察到下层CCl4由无色变为紫红色,后看到上层溶液由浅绿色变为黄色.
②氯气是黄绿色的气体,氯气和氨气能生成氯化氢气体,氯化氢和氨气相遇立即生成白烟氯化铵,所以看到的现象是黄绿色气体消失,产生白烟;烧瓶内气体反应后压强减小,烧瓶内外导致产生压强差,所以烧杯中的水进入烧瓶产生喷泉.
故答案为:黄绿色气体消失,产生白烟;烧杯中的液体进入烧瓶中,形成喷泉.
③要使分液漏斗中的液体顺利流下,应使分液漏斗内外产生压强差,外界大气压产生的压强导致溶液流下,所以正确操作是将F装置中分液漏斗顶端的塞子打开,再打开分液漏斗的旋塞,使分液漏斗中的液体流下.
故答案为:将F装置中分液漏斗顶端的塞子打开,再打开分液漏斗的旋塞,使分液漏斗中的液体流下.
(2)①亚硫酸根离子有还原性,能被强氧化剂氧化成硫酸根离子,所以要想使亚硫酸根离子生成硫酸根离子,应选择氧化性物质.
A、虽然酸性高锰酸钾有强氧化性,但有硫酸根离子造成干扰,故A错误.
B、氢氧化钠没有氧化性,故B错误.
C、氯水有强氧化性,且不造成干扰,故C正确.
D、碘化钾有还原性没有氧化性,故D错误.
故选C.
②氯气有氧化性,亚硫酸根离子有还原性,所以亚硫酸根离子和氯气能发生氧化还原反应生成氯离子、硫酸根离子和氢离子Cl2+SO32-+H2O=2Cl-+SO42-+2?H+.
故答案为Cl2+SO32-+H2O=2Cl-+SO42-+2?H+.
③由固、液混合溶液得纯净、干燥的沉淀的操作要经过滤、洗涤、干燥.
故答案为:过滤、洗涤、干燥.
④二氧化硫和二氧化碳都能使澄清的石灰水变浑浊,但二氧化硫具有还原性,能使酸性高锰酸钾褪色,要想检验碳酸根离子,首先要排除亚硫酸根离子的干扰,再将气体通入澄清的石灰水,若石灰水变浑浊,则证明废水中含有CO32-,否则没有.
故答案为:向废水中加入足量的盐酸,将生成的气体先通入足量的?酸性KMnO4溶液,再通入澄清石灰水,若紫色KMnO4溶液颜色变浅,石灰水变浑浊,则证明废水中含有CO32-.
本题解析:
本题难度:一般