1、实验题 二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/cm3,遇水易分解,以下是由氯气与硫反应合成二氯化硫的实验装置,其中F中装有无水CaCl2固体。

试回答下列问题:
(1)装置A中发生反应的化学方程式为:_____________________________
(2)装置C中盛放的试剂是_______________ ,装置F的作用为________________________
(3)实验开始前先排尽系统中空气,此做法目的是 再向D中放入一定量的硫粉,加热使之融化,然后摇动烧瓶使硫附着在烧瓶内壁形成一薄层膜,这样做的目的是____________________________
(4)实验时,如何防止E中液体挥发____________________________
(5)画出虚线框内与F连接的仪器,并指出其中盛装试剂名称,以完善该实验装置
参考答案:
(1)MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
(2)浓硫酸;防水从后面进入E使二氯化硫分解
(3)防止加热硫粉时,空气中的氧气与硫粉反应,增大接触面积以加快反应速率。
(4)将锥形瓶放入冰水中冷却
(5) 
本题解析:
本题难度:一般
2、实验题 在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2。

(1)I、II、III、IV装置可盛放的试剂是I_______;II_________;III_______;IV_______(将下列有关试剂的序号填入空格内); A.品红溶液 B.NaOH溶液 C.浓H2SO4 D.酸性KMnO4溶液
(2)能说明SO2气体存在的现象是____________________________;
(3)使用装置II的目的是____________________________;
(4)使用装置III的目的是____________________________;
(5)确定含有乙烯的现象是____________________________。
参考答案:(1)I、A;II、B;III、A;IV、D
(2)能说明SO2气体存在的现象是装置Ⅰ中品红褪色
(3)使用装置II的目的是除去SO2以免干扰乙烯的检验
(4)使用装置III的目的是检验SO2是否被完全除去
(5)确定含有乙烯的现象是装置III中品红不褪色装置Ⅳ中酸性KMnO4溶液褪色
本题解析:
本题难度:一般
3、简答题 某研究性学习小组查阅资料得知:漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(C1O)2+CaCl2+H2SO4
2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质.

试回答下列问题:
(1)每生成1mol?Cl2,上述化学反应中转移的电子个数为______?(NA表示阿伏加德罗常数).
(2)该实验中A处可选用装置______(填写甲.乙.丙或丁).
(3)检查A装置的气密性的方法是用弹簧夹夹住______处(填a.b.c或d)橡皮管,向分液漏斗中加水并打开活塞,当加到一定量时,停止加水,静止观察,当观察到分液漏斗中______?时,表明该装置不漏气.
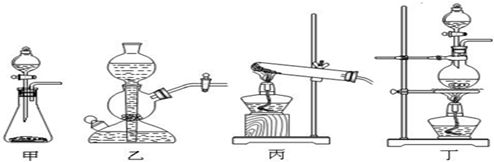
(4)装置B中发生反应的离子方程式为______.
(5)装置C中发生反应的离子方程式为______
(6)装置E中的试剂是______(任填一种合适试剂的名称),其作用是______
(7)请帮助该学习小组同学设计一个实验,证明装置D中有FeCl3生成(请简述实验步骤)______.
参考答案:(1)Ca(C1O)2+CaCl2+H2SO 4??△?.?2CaSO4+2Cl2↑+2H2O? 转移电子
?2?mol? 2 NA?
? 1mol? NA?
故答案为:NA?
(2)反应物的状态为固体和液体,反应条件是加热.
故选丁.
(3)夹住橡皮管,向分液漏斗中加水并打开活塞,如果漏气,分液漏斗内压强减小,水面会下降,否则不含下降.
故答案为:a,液面(水面)不下降.
(4)漏气有氧化性,能置换出碘单质,
故答案为:Cl2+2I-=I2+2Cl-
(5)氯气有氧化性,亚硫酸钠有还原性,氯气和亚硫酸钠能发生氧化还原反应,生成硫酸钠和盐酸.
故答案为:Cl2+SO32-+H2O=SO42-+2H++2Cl-
(6)氯气有毒,不能直接排空,因为氯气和水反应生成盐酸和次氯酸,酸能和碱反应,从而达到吸收氯气的作用.故答案为:氢氧化钠溶液或碳酸钠溶液;?吸收多余的氯气,防止污染空气.
(7)三价铁离子和硫氰化钾反应,使溶液变成血红色.
故答案为:取装置D中的溶液于一支洁净试管中,滴加适量的KSCN溶液,溶液变成血红色,则证明有FeCl3生成.
本题解析:
本题难度:一般
4、选择题 用分液漏斗和烧杯可以装配成一套简易的,能随开随用、随关随停的气体发生装置,如图所示。能用此装置制备的气体有
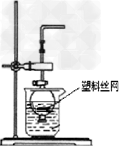
[? ]
A.?用块状大理石与稀硫酸反应制取CO2?
B.?用锌粒与稀硫酸反应制取H2
C.?用过氧化钠与水反应制取O2
D.?用二氧化锰与浓盐酸反应制取Cl2
参考答案:B
本题解析:
本题难度:一般
5、简答题 某校化学兴趣小组的同学利用漂白粉与稀硫酸在加热条件下反应制取Cl2,其反应的化学方程式为:Ca(ClO)2+CaCl2+2H2SO4
2CaSO4+2Cl2↑+2H2O.以下是制取Cl2并验证其部分性质的实验装置.

试回答下列问题:
(1)请在上图(右上装置中)选择满足实线框图I的气体发生装置:______(填代号);
(2)实验装置Ⅲ的作用是______;
(3)一段时间后,装置Ⅲ的溶液仍呈强碱性,其中肯定存在Cl-、OH-和SO42-,请设计实验探究该吸收液中可能存在的其它阴离子(不考虑空气中CO2的影响).
①提出合理假设:假设1:只存在SO32-;?假设2:只存在ClO-;?假设3:______
②设计实验方案进行实验,请写出实验步骤以及预期现象和结论.实验试剂:3mol?L-1?H2SO4、1mol?L-1?NaOH、0.01mol?L-1?KMnO4、淀粉KI溶液、紫色石蕊试液. | 实验步骤 | 预期现象和结论
步骤1:取少量吸收液于试管中,滴加3mol?L-1 H2SO4至溶液显酸性,然后将所得溶液分置于A、B试管中.
/
步骤2:______
______?
步骤3:______
______?
参考答案:(1)反应物是固体和液体,反应条件是加热,所以应选择固、液混合加热型装置,故答案为:b;
(2)二氧化硫和氢氧化钠反应生成亚硫酸钠,氯气有毒,所以不能直接排空,氯气和亚硫酸钠、氢氧化钠反应转化为无毒物质,Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O,所以该装置的作用是吸收多余氯气,防止污染大气.
故答案为:吸收多余氯气,防止污染大气;
(3)①根据反应原理:Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O,可提出以下假设:
假设1、溶液中可能存在只存在SO32-,
假设2、溶液中只存在ClO-,
假设3、既不存在SO32-也不存在ClO-.
②因为吸收液呈碱性,先取少量吸收液于试管中,滴加3moL-L-1?H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中先加入硫酸的试管,若存在SO32-、ClO-,分别生成了H2SO3和HClO;
在A试管中滴加0.01mol?L-1KMnO4溶液,若紫红色褪去,证明有SO32-,否则无.
在B试管中滴加紫色石蕊试液,若先变红后褪色,证明有ClO-,否则无;
故答案为:既不存在SO32-,也不存在ClO-;
实验步骤预期现象和结论?步骤2:向A试管中加入O.Olmol?L-1
KMnO4溶液,振荡试管.(1)若溶液褪色,则假设1成立;
(2)若不褪色,则假设2或假设3成立.步骤3;向B试管中滴加紫色石蕊试液.(1)若先变红后褪色,则假设2成立;(2)若不褪色,则假设1或假设3成立.
本题解析:
本题难度:一般
|