1、填空题 在新型有机高分子材料中,有一种感光高分子材料,也称为光敏高分子,是一种在彩电光屏及大规模集成电路的制造中使用的功能高分子材料,其结构简式为:
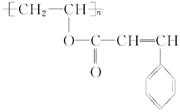
已知它是由两种化合物经酯化后聚合而成的,这两种化合物的结构简式为:__________________________。
参考答案: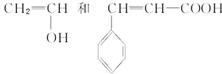
本题解析:从乙烯合成聚乙烯可知加聚反应中单体与高聚物之间有如下特点:单体与高聚物结构单元的原子种类和数目完全相同,并且单体的碳链和高聚物分子链节中的碳链也相同,仅存在双键变单键的变化。本题中高聚物分子链节的主链上只存在两个碳原子,因此只将高聚物分子式中的括号与聚合度n去掉,然后将主链上的单键变为双键即可得到加聚反应前的单体:
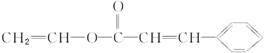
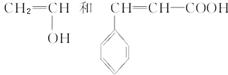
该单体存在酯的结构,根据酯的特点可拆分得出合成单体的两种化合物分别为:
本题难度:简单
2、选择题 目前复合材料主要应用在航天工业。宇航员在升空、返回或遇到紧急情况时,必须穿上10公斤重的舱内 航天服,“神六”宇航员所穿的舱内航天服是我国科学家近年来研制的新型“连续纤维增韧”航空材料做成,其主要是由碳化硅、陶瓷和碳纤维复合而成的,下列相关叙述错误的是
[? ]
A.它耐高温,抗氧化
B.它比钢铁轻、硬,但质地较脆
C.它没有固定熔点
D.它是一种新型无机非金属材料
参考答案:B
本题解析:
本题难度:简单
3、选择题 接触法生产H2SO4的过程中,对废气、废液、废渣和“废热”的处理正确的是
①尾气用氨水处理?②污水用石灰乳处理③废渣用来炼铁、制水泥等④将“废热”通过“废热”锅炉产生蒸气发电.
A.只有①②
B.只有①③④
C.只有①②③
D.全部
参考答案:D
本题解析:分析:依据对废气、废液、废渣和“废热”的利用和处理分析选项的正确性;
解答:①硫酸厂尾气中含有SO2,可用氨水吸收处理;2NH3+H2O+SO2=(NH4)2SO3,或NH3+H2O+SO2=NH4HSO3;故①正确;
②硫酸厂废水中含有H2SO4,可用石灰乳中和;Ca(OH)2+H2SO4═CaSO4+2H2O;故②正确;
③硫酸厂废渣中含有SiO2、Fe2O3等,可用于制造水泥、炼铁;废物利用,故③正确;
④由于硫酸生产过程中三个化学反应都是放热反应,可以充分利用这些反应放出的热能来降低生产成本;故④正确;
综上所述,答案为D;
故选D.
点评:本题考查了对废气、废液、废渣和“废热”的处理,处理的目的和应用,熟练掌握工业制备的流程,尾气的处理原则,除杂的分析应用是解题关键.
本题难度:一般
4、简答题 【化学—选修2:化学与技术】(15分)
 请回答氯碱工业的如下问题:
请回答氯碱工业的如下问题:
 (1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
 (2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
 (3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。?
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。?

 ①图中X是__?___(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
①图中X是__?___(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
 ②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:_____;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:_____;
 ③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
参考答案:(15分)(1)k=M(Cl2)/2 M(NaOH)=71/80=1:1.13或0.89(2分)
(2)③①②(2分)?(3)①Cl2(1分)?a%小于b%?(2分)
②O2+4e-+2H2O=4OH-?(2分)?H2-2e-+2OH-=2H2O (2分)
③燃料电池可以补充电解池消耗的电能(2分));提高产出碱液的浓度(2分;降低能耗(其他合理答案也给分)
本题解析:(1)惰性电极电解饱和食盐水的方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2, ↑,根据方程式可知氯气和氢氧化钠的物质的量之比是1︰2,所以质量之比是)k=M(Cl2)/2 M(NaOH)=71/80=0.89。
2NaOH+H2↑+Cl2, ↑,根据方程式可知氯气和氢氧化钠的物质的量之比是1︰2,所以质量之比是)k=M(Cl2)/2 M(NaOH)=71/80=0.89。
(2)由于除去SO42-时要加入过量的氯化钡溶液,而过量的氯化钡需要碳酸钠除去,所以正确的操作顺序是③①②。
(3)①由于在燃料电池中失去电子的是氢气,所以Y是氢气,则X就是氯气。由于燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于b%。
②负极是氢气失去电子,正极氧气得到电子,所以电极反应式分别为H2-2e-+2OH-=2H2O 、O2+4e-+2H2O=4OH- 。
③根据装置特点及反应过程可知,这样设计的优点是燃料电池可以补充电解池消耗的电能;提高产出碱液的浓度;降低能耗等。
本题难度:一般
5、选择题 铸造硬币所用合金的实际价值比其面值
A.高
B.低
C.相等
D.高或相等
参考答案:C ?
本题解析:硬币的实际价值与其面值等价。
本题难度:一般