1、填空题 (本题共13分)A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E顺序增大;C、D都能分别与A按原子个数比为1∶1或2∶1形成化合物;CB可与EA2反应生成C2A和气体物质EB4;EB4蒸气的密度是相同条件下空气密度的3.586倍。
23、指出A在元素周期表中的位置_________。
24、写出D2A2的电子式__________;写出CB与EA2反应的化学方程式___________________。
25、下表是不同物质中的键长和键能的数据,其中a、b、d未知,通过表中的数据分析,估计出a、b、c、d的大小顺序为______________________________。
共价键
| C-C
| C=C
|  C C C C
| C-O
| C=O
| H-F
| N=N
|  N N N N
|
键长(nm)
| 0.154
| 0.134
| 0.120
| 0.143
| 0.122
| 0.092
| 0.120
| 0.110
|
键能(kJ/mol)
| a
| b
|
| 358
| c=805
| 569
| d
|
|
氟和氟盐是化工原料。由于氟气性质活泼,很晚才制取出来。
26、不能通过电解纯净的液态HF获得F2,其原因是_________;但电解液态KHF2时,两极分别得到F2和H2,则F2在电解池的_____极产生。
27、利用化学反应也能制取氟。请配平下列化学方程式:
____K2MnF6+____SbF5→____KSbF6+____MnF3+____F2↑
28、一定浓度的HF和Al2(SO4)3混合液中,铝的各种微粒含量f随pH的分布曲线如图示。
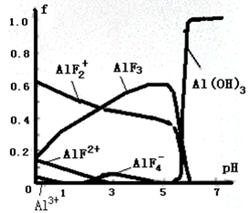
用NaOH使混合液的pH从5调整到7,写出有关反应的离子方程式:____________________。
参考答案:23、第二周期第ⅥA族 24、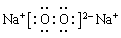 ;4HF+SiO2→SiF4+2H2O 25、a<b<c<d;键越长
;4HF+SiO2→SiF4+2H2O 25、a<b<c<d;键越长
26、氟化氢是共价化合物,纯液态时不电离,因而不导电 (1分);阳(1分)
27、2 4 4 2 1(2分)
28、AlF2++3OH-→Al(OH)3↓+2F-(2分),AlF3+3OH-→Al(OH)3↓+3F-(2分)
本题解析:A、B、C、D、E五种短周期元素, C、D都能分别与A按原子个数比为1∶1或2∶1形成化合物,这说明A是氧元素,C是氢元素,D是钠元素。C、A、B、D、E的核电荷数依次增大,因此B是F元素;CB可与EA2反应生成C2A和气体物质EB4,EB4蒸气的密度是相同条件下空气密度的3.586倍,则其相对分子质量是29×3.586=104,所以E的相对原子质量是104-19×4=28,因此E是硅元素。则
23、氧元素的原子序数是8,位于元素周期表的第二周期第ⅥA族。
24、根据以上分析可知D2A2是过氧化钠,属于离子化合物,电子式为 ;HF与二氧化硅反应的化学方程式4HF+SiO2→SiF4+2H2O ;
;HF与二氧化硅反应的化学方程式4HF+SiO2→SiF4+2H2O ;
25、根据表中数据可知碳碳单键的键能小于碳碳双键的键能,则a<b;键长越短,键能越大,所以a<b<c<d;
26、氟化氢是共价化合物,液态时不电离,因此不能导电;电解液态KHF2时,两极分别得到F2和H2,其中F元素的化合价由-1价升高到0价失去电子,被氧化,所以F2在电解池的阳极产生。
27、根据反应式可知Mn元素的化合价从+4价降低到+3价,得到1个电子;F元素的化合价从-1价升高到0价,失去1个电子,则根据电子得失守恒可知配平后的方程式为2K2MnF6+4SbF5→4KSbF6+2MnF3+F2↑;
28、根据图像可知用NaOH使混合液的pH从5调整到7时AlF3的浓度降低,而氢氧化铝增大,这说明AlF3转化为氢氧化铝,因此反应的离子方程式为AlF3+3OH-→Al(OH)3↓+3F-。
考点:考查元素及物质推断、元素周期律的应用、氧化还原反应方程式配平、铝及其化合物的转化等
本题难度:困难
2、填空题 有一块锌片插入足量CuSO4溶液1L中,可以观察到锌片表面有黄色附着物析出,最后称量时锌片质量减轻了0.1g(假设溶溶液体变化忽略不计),求:
(1)(1)参加反应的还原剂的物质的量是 ;
(2)还原产物的物质的量是 ;
(3)生成ZnSO4的物质的量浓度是 ;
(4)溶液的质量 ;(填“增加”或“减少”)
(5)写出该反应的离子方程式 。
参考答案:
(1)0.1 mol (2) 0.1 mol(3)0.1 mol/L(4)增加 (5)Zn + Cu2+ = Zn2+ + Cu
本题解析:锌片插入足量CuSO4溶液发生反应为:Zn+CuSO4=ZnSO4+Cu。锌是还原剂,CuSO4是氧化剂,ZnSO4还原产物,Cu是还原产物。根据方程式可得每有1mol锌即65克参加反应就生成64克铜,对固体来说质量减少;对溶液来说质量增加。这时固体质量减少1克,现在质量减少0.1克,所以参加反应的还原剂锌的物质的量是0.1摩尔,C(ZnSO4)=0.1mol/1L=0.1 mol/L.该反应的离子方程式是:)Zn + Cu2+ = Zn2+ + Cu。
考点:考查离子反应方程式的书写及氧化还原反应的有关概念及相应的化学计算等的知识。
本题难度:一般
3、填空题 向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式: 。
(2)下列三种情况下,离子方程式与 (1)相同的是 (填序号)。
A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀
C.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
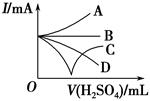
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用如图中的 (填序号)曲线表示。
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示。向该烧杯中缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将 。
参考答案:(1)Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O (2)A (3)C (4)下沉
本题解析:(1)向Ba(OH)2溶液中逐滴加入稀硫酸,反应的离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O。(2)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至溶液显中性,反应的离子方程式为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O;向NaHSO4溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀,离子方程式为:Ba2++OH-+SO42-+H+=BaSO4↓+H2O;向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量,反应的离子方程式为:H++SO42-+Ba2++OH-=BaSO4↓+H2O。(3)向Ba(OH)2溶液中缓缓加入稀硫酸,当Ba(OH)2与H2SO4恰好完全反应时,溶液导电能力接近为零,再加过量稀硫酸,溶液导电能力又增强,故曲线C正确。(4)Ba(OH)2与H2SO4反应过程中,随反应的进行,溶液密度变小,塑料小球下沉。
本题难度:一般
4、填空题 (11分)过氧化氢是用途很广的绿色氧化剂,它的水溶液俗称双氧水,常用于消毒、杀菌、漂白等。试回答下列问题:
(1)写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程式:____________。
(2)Na2O2,K2O2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。则上述最适合的过氧化物是________。
(3)甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上,实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入到质量分数为30%-70%的过氧化氢溶液中,则该反应的化学方程式为________,过氧化氢比理论用量稍多,其目的是________。反应温度最好控制在30 -70℃,温度不易过高,其主要原因是________。
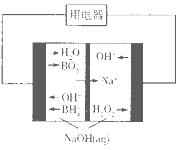
(4)下图是硼氢化钠一过氧化氢燃料电池示意图。该电池工作时,正极附近溶液的pH________(填“增大”、“减小”或“不变”)。
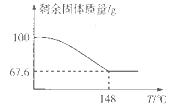
(5)Na2CO3·xH2O2可消毒、漂白。现称取100 g的Na2CO3·xH2O2晶体加热,实验结果如图所示,则该晶体的组成为________。
参考答案:(1)H2O2+2H++2Fe2+=2Fe3++2H2O(2分)
(2)BaO2(1分)
(3)Ca(OH)2+2HCHO+2H2O2=Ca(HCOO)2+4H2O(2分) 使甲醛充分氧化,提高甲醛的利用率和产品纯度(1分) 防止H2O2分解和甲醛挥发(1分)
(4)增大(2分)
(5)Na2CO3·1.5H2O2(2分)
本题解析:(1)酸性条件下H2O2氧化氯化亚铁生成氯化铁和水,反应的离子方程式为:
H2O2+2H++2Fe2+=2Fe3++2H2O;(2)实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,说明生成了硫酸钡沉淀,所以选用BaO2;(3)氢氧化钙和甲醛溶液依次加入到质量分数为30%-70%的过氧化氢溶液中生成甲酸钙和水,该反应的化学方程式为:Ca(OH)2+2HCHO+2H2O2=Ca(HCOO)2+4H2O;过氧化氢比理论用量稍多,其目的是:使甲醛充分氧化,提高甲醛的利用率和产品纯度,反应温度最好控制在30 -70℃,温度不易过高,其主要原因是:防止H2O2分解和甲醛挥发;(4)该装置为原电池,正极是阳离子流向的一极,即过氧化氢所在的一极,发生还原反应,电极反应式为H2O2+2e-=2OH-,溶液的pH增大;(5)设该晶体的组成为:Na2CO3·xH2O2:2Na2CO3?xH2O2 =2Na2CO3+xO2↑+2xH2O,根据温度和残留固体的相对质量分数示意图,当温度为148℃时,所得固体只有碳酸钠,质量分数为67.6%,所以固体质量减少的百分数为 68x /(212+68x)×100%=1-67.6%,解得x=1.5,则该晶体的组成为Na2CO3·1.5H2O2。
考点:考查氧化还原反应,离子方程式的书写,化学电源和化学式的确定。
本题难度:一般
5、选择题 下列表示对应化学反应的离子方程式正确的是 ( )
A.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
B.硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑
C.NH4HCO3溶于过量的NaOH溶液中:HCO—3+OH—=CO2-3+H2O
D.向氯化铝溶液中加入过量氢氧化钠溶液:Al3++4OH—=AlO—2+2H2O