|
高考化学必考知识点《离子方程式的书写及正误判断》练习题(四)
2021-06-11 05:46:07
【 大 中 小】
|
1、选择题 下列离子方程式书写正确的是
A.过量的NaHSO4与Ba(OH)2溶液反应:Ba2+ + 2OH- + 2H+ + SO42- = BaSO4 ↓+ 2H2O
B.NH4HCO3溶液与过量NaOH溶液反应:NH4+ + OH- = NH3 ↑+ H2O
C.次氯酸钙溶液中通入少量二氧化碳:2ClO- + CO2 + H2O =" 2HClO" + CO32-
D.FeBr2溶液中通入过量Cl2:2Fe2+ + 2Br- + 2Cl2 = 2Fe3+ + Br2 + 4Cl-
|
参考答案:A
本题解析:略
本题难度:一般
2、选择题 在学习中,我们经常应用类推法。下列左边正确,类推法应用于右边也正确的是
AA
| 向FeCl2溶液中滴入氯水
2Fe2++ Cl2= 2Fe3++ 2Cl—
| 向FeCl2溶液中滴入碘水
2Fe2++ I2= 2Fe3++2I—
| B
| CO2通入漂白粉溶液中
CO2+ Ca2++2ClO—+H2O=CaCO3↓+ 2HClO
| SO2通入漂白粉溶液中
SO2 +Ca2++2ClO—+H2O=CaSO3↓+2HClO
| C
| 向Na2CO3溶液中滴入稀HNO3
CO32—+ 2H+ = CO2↑+ H2O
| 向Na2SO3溶液中滴入稀HNO3
SO32— +2H+ = SO2↑+H2O
| D
| 向澄清石灰水中通入少量CO2气体
Ca2++2OH— +CO2= CaCO3↓+ H2O
| 向澄清石灰水中通入少量SO2气体
Ca2++2OH— +SO2= CaSO3↓+H2O
|
参考答案:D
本题解析:
试题解析:A.FeCl2溶液与碘水不反应,则前者发生氧化还原反应,后者不反应,与氧化性有关,故A错误;
B.SO2通入漂白粉溶液,发生氧化还原反应为SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl-,故B错误;
C.Na2SO3溶液中滴入稀HNO3发生氧化还原反应为2NO3-+3SO32-+2H+=3SO42-+2NO↑+H2O,故C错误;
D.二氧化碳、二氧化硫均为酸性氧化物,与碱反应均生成盐和水,则类推合理,故D正确。
考点:离子方程式的书写
本题难度:困难
3、填空题 (8分)完成下列反应的离子方程式:
(1)将AlCl3溶液蒸干得到白色固体: ;
(2)用惰性电极电解饱和食盐水: ;
(3)用KOH做电解质溶液的甲烷燃料电池的负极反应式: ;
(4)往AgCl悬浊液中滴加Na2S溶液: ;
参考答案:(1)Al3+ +3 Cl— + 3H2O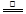 Al(OH)3↓+ 3HCl↑(2)2Cl— + 2H2O Al(OH)3↓+ 3HCl↑(2)2Cl— + 2H2O 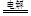 Cl2↑+ H2↑+ 2OH— Cl2↑+ H2↑+ 2OH—
(3)CH4 + 10OH——8e— = CO32— +7H2O (4)2AgCl + S2— = Ag2S + 2Cl—
本题解析:(1)将AlCl3溶液蒸干生成氢氧化铝,离子方程式为Al3+ +3 Cl— + 3H2O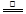 Al(OH)3↓+ 3HCl↑;(2)用惰性电极电解饱和食盐水生成氢气、氯气、氢氧化钠,离子方程式为2Cl— + 2H2O Al(OH)3↓+ 3HCl↑;(2)用惰性电极电解饱和食盐水生成氢气、氯气、氢氧化钠,离子方程式为2Cl— + 2H2O 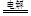 Cl2↑+ H2↑+ 2OH—; Cl2↑+ H2↑+ 2OH—;
(3)用KOH做电解质溶液甲烷燃料电池中,甲烷作负极,负极反应式为CH4 + 10OH——8e— = CO32— +7H2O;(4)往AgCl悬浊液中滴加Na2S溶液发生沉淀的转化,离子方程式为2AgCl + S2— = Ag2S + 2Cl—。
考点:考查离子方程式的书写。
本题难度:一般
4、填空题 (16分)我国规定饮用水质量标准必须符合下列要求:
pH
| 6.5~6.8
| Ca2+、Mg2+总浓度
| <0.0045mol/L
| 细菌总数
| <100个/L
|
以下是源水处理成自来水的工艺流程示意图:
源水→曝气池 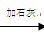 一级沉降池 一级沉降池 二级沉降池 二级沉降池 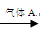 过滤池→自来水 过滤池→自来水
(1)源水中含Ca2+ 、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式 。
(2)凝聚剂除去悬浮固体颗粒的过程 (填写编号,多选倒扣分)
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4.7H2O是常用的凝聚剂,它在水中最终生成 沉淀。
(3)通入二氧化碳的目的是 和 。
(4)气体A的作用是 。这种作用是基于气体A和水反应的产物
具有 性.
(5)下列物质中, 可以作为气体A的代用品。(填写编号,多选倒扣分)
①Ca(ClO)2 ②NH3 (液) ③K2FeO4 ④SO2
参考答案:(16分)(1)Mg2++OH-=Mg(OH)2↓ …………2分
(2)③ …………2分 Fe(OH)3 …………2分
(3)将Ca2+除去,…………2分;同时调整溶液中的pH达到饮用水质量标准 ………2分
(4)消毒杀菌 …………2分 强氧化性…………2分 (5)①和③…………2分
本题解析:(1)源水中含Ca2+ 、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式是Mg2++OH-=Mg(OH)2↓。
(2)凝聚剂除去悬浮固体颗粒的过程首先是亚铁被氧化成三价铁,然后生成Fe(OH)3胶体,再进行吸附降沉,所以选择③
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4.7H2O是常用的凝聚剂,它在水中最终生成Fe(OH)3沉淀。
(3)通入二氧化碳的目的是将Ca2+除去和同时调整溶液中的pH达到饮用水质量标准。
(4)气体A的作用是消毒杀菌,同常识氯气。这种作用是基于气体A和水反应的产物是次氯酸,
具有强氧化性性.
(5)下列物质中,①和③具有强氧化性,所以可以作为气体A的代用品。
考点:化学工艺
点评:此类题目考查学生对所学知识的熟练运用能力,就氯气而言,常运用在自来水消毒过程中,只要熟悉氯气的性质,此题便不难解决。
本题难度:一般
5、选择题 下列离子方程式书写正确的是
A.向NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH- = BaSO4↓+H2O
B.NaClO溶液与FeCl2溶液混合:Fe2+ + 2ClO- + 2H2O = Fe(OH)2↓ + 2HClO
C.NH4HSO3溶液与足量NaOH溶液反应:NH4+ + OH-= NH3↑ + H2O
D.将1mol/LNaAlO2溶液和1.5mol/L的HCl溶液等体积均匀混合:6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+
| 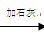 一级沉降池
一级沉降池 二级沉降池
二级沉降池 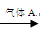 过滤池→自来水
过滤池→自来水