1、选择题 用类推的方法可能会得出错误结论,因此推出的结论要经过实践的检验才能确定其正确与否.下列类推结论中正确的是
[? ]
A.Na失火不能用CO2灭火,K失火不能用CO2灭火
B.工业上电解熔融MgCl2制取金属镁,也用电解熔融AlCl3的方法制取金属铝
C.Al与S直接化合可以得到Al2S3,Fe与S直接化合也可以得到Fe2S3
D.Fe3O4可以写成FeO·Fe2O3,Pb3O4也可写成PbO·Pb2O3
参考答案:A
本题解析:
本题难度:简单
2、选择题 某同学设计如下实验测量m g铜银合金样品中铜的质量分数:
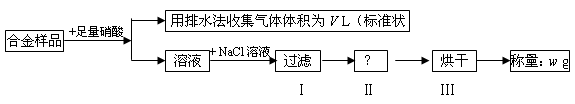
下列说法中不正确的是
A.收集到的V L气体为 NO
B.过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒
C.操作Ⅱ应是洗涤
D.铜的质量分数为: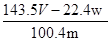 ×100%
×100%
参考答案:D
本题解析:铜和银与硝酸反应,生成NO2或NO,但通过排水法收集到的气体是NO。溶液中加入氯化钠生成氯化银沉淀,即氯化银的质量是wg。所以根据原子守恒可知,合金中银的质量是 ,则铜的质量分数为
,则铜的质量分数为 ,即选项D是错误的,其余都是正确的,答案选D。
,即选项D是错误的,其余都是正确的,答案选D。
本题难度:一般
3、选择题 向一定量的Fe、FeO和Fe2O3的混合物中加入120mL 4mol·L-1的稀硝酸,恰好使混合物完全溶解,放出1.344L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为(? )
A.0.24 mol
B.0.21 mol
C.0.16 mol
D.0.14 mol
参考答案:B
本题解析:120mL 4mol·L-1的稀硝酸 ;1.344L NO(标准状况)的物质的量为
;1.344L NO(标准状况)的物质的量为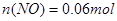 ,由于反应后铁以硝酸亚铁形式存在,由N元素守恒可得反应后生成的硝酸亚铁的物质的量为
,由于反应后铁以硝酸亚铁形式存在,由N元素守恒可得反应后生成的硝酸亚铁的物质的量为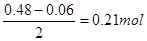 ,即原Fe、FeO和Fe2O3的混合物中铁元素的物质的量为0.21mol;
,即原Fe、FeO和Fe2O3的混合物中铁元素的物质的量为0.21mol;
本题难度:一般
4、填空题 现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。
某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2),现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段。
?
已知:①Cu2O+2H+=Cu2++Cu+H2O;②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混
合液浸出铜;③反萃取后的水层2是硫酸铜溶液。
回答下列问题:
(1) 矿石用稀硫酸处理过程中发生反应的离子方程式为:Cu2O+2H+=Cu2++Cu+H2O、
?、?(任写其中2个)。
(2)“循环Ⅰ”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体,该晶体
的化学式是?。若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写
出水层1暴露在空气中发生反应的离子方程式?。
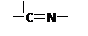 (3)“循环Ⅱ”中萃取剂是一类称作为肟类的有机化合物,如N-510、N-530等。某肟类化合物A的分
(3)“循环Ⅱ”中萃取剂是一类称作为肟类的有机化合物,如N-510、N-530等。某肟类化合物A的分
子结构中仅含n1个 —CH3、n2个 —OH 和n3个?三种基团,无环状结构,三种基团的数
目关系为n3=?。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,
则A的结构简式是?。
(4) 写出电解过程中阳极(惰性电极)发生反应的电极反应式:?。
(5)“循环Ⅲ”中反萃取剂的主要成分是?。
参考答案:(1) CuO+2H+==Cu2++H2O、Fe2O3+6H+==2Fe3++3H2O、Cu+2Fe3+==2Fe2++ Cu2+?
(2) FeSO4?7H2O ,4Fe2++O2+4H+==4Fe3+ +2H2O
(3) n3= (n1+n2-2)? CH3—C(=N-OH)—C(=N-OH)—CH3
(4) 4OH--4e-="=" O2+2H2O? (5) H2SO4
本题解析:本题看似考察酸浸法从矿石中提取铜这样一个复杂的工艺流程,实际上考察了常见金属及其化合物的性质(1、2两问)、电解精炼铜(4、5两问)及对有机物结构的体认(3) 。
(1)由矿石成分知氧化铜、氧化铁与硫酸反应。

 (2)因有铜单质析出,故不能存在亚铁离子,且亚铁离子的强还原性易被氧化为铁离子。
(2)因有铜单质析出,故不能存在亚铁离子,且亚铁离子的强还原性易被氧化为铁离子。
(3)—CH3、 —OH是端头基。?是分子的骨架,一个?就需多一个端头基,加上链首尾的两个端头基,共需端头基n3+2,即n3+2=n1+n2。
(4) 电解精炼铜,阳极放电离子是OH-。
(5)由电解精炼铜知生成硫酸,反萃取剂是硫酸。
本题难度:一般
5、填空题 氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
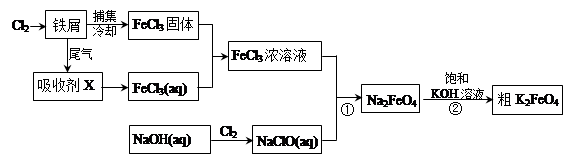
请回答下列问题:
(1)氯化铁有多种用途:
①氯化铁做净水剂。请用离子方程式表示其原理____________?__________;
②工业上常用FeCl3溶液腐蚀铜印刷线路板。这是利用了FeCl3较强的__________性。
(2)吸收剂X的化学式为? ?。为检验吸收剂是否已完全转化为FeCl3溶液,有人设计用酸性高锰酸钾溶液,但很快被否定,理由是(用离子方程式表示)?。正确的检验方法是:取少量待测液,加入?(写化学式)溶液,若无深蓝色沉淀产生,则证明转化完全。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+Na2FeO4  K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因?。
K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因?。
(5)将粗K2FeO4产品经重结晶、过滤、?、?,即得较纯净的K2FeO4。
参考答案:(1)①Fe3++3H2O
 Fe(OH)3 (胶体) + 3H+?②氧化
Fe(OH)3 (胶体) + 3H+?②氧化
(2)FeCl2?10Cl-+2MnO4-+16H+=5Cl2↑+2Mn2++ H2O?铁氰化钾或K3[Fe(CN)6] (写成K3Fe(CN)6也可)
(3)3ClO-+2Fe3++10OH-==2FeO42-+3Cl-+5H2O
(4)K2FeO4的溶解度比Na2FeO4小而溶液中K+、FeO42-的浓度比较大(合理答案均计分)
(5)洗涤、干燥
本题解析:(1)①氯化铁做净水剂是因为Fe3+水为Fe(OH)3胶体的缘故;②工业上常用FeCl3溶液腐蚀铜印刷线路板。是Fe3+氧化了Cu的缘故,FeCl3较强的氧化性。
(2)吸收剂X的与Cl2反应的产物是FeCl3,X是FeCl2。为检验吸收剂是否已完全转化为FeCl3溶液,用酸性高锰酸钾溶液不能验证,因为Cl-能被酸性高锰酸钾氧化为Cl2。Fe2+与铁氰化钾溶液或深蓝色沉淀产生,可用此显色反应来验证是否存在Fe2+。
(3)碱性条件下根据反应物和产物可知,反应①的离子方程式为3ClO-+2Fe3++10OH-==2FeO42-+ 3Cl-+5H2O。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+Na2FeO4  K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因K2FeO4的溶解度比Na2FeO4小而溶液中K+、FeO42-的浓度比较大。
K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因K2FeO4的溶解度比Na2FeO4小而溶液中K+、FeO42-的浓度比较大。
(5)将粗K2FeO4产品经重结晶、过滤、洗涤、干燥,即得较纯净的K2FeO4。2+、Fe3+、K2FeO4之间的转化及其各自的性质、鉴别方法。
本题难度:一般