1、选择题 下列过程中,需要减慢化学反应速率的是
A.炼钢
B.炼铁
C.合成纤维
D.食物腐败
参考答案:D
本题解析:食物的腐败会影响食物的使用,增加成本,浪费资源,所以答案选D。
本题难度:简单
2、选择题 相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)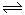 2NH3(g)△H=-92.4kJ/mol,实验测得起始、平衡时的有关数据如下表:
2NH3(g)△H=-92.4kJ/mol,实验测得起始、平衡时的有关数据如下表:
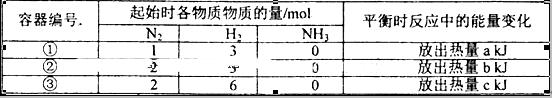
下列叙述正确的是
A.放出热量关系:a<b <92.4
B.三个容器内反应的平衡常数:③>①>②
C.达平衡时氨气的体积分数:①>③
D.N2的转化率:②>①>③
参考答案:A
本题解析:A、①、②相比,②的氮气的浓度较大,氢气浓度相等,所以②的氢气的转化率高,放出的热量多,但氢气不会完全转化,所以放出的热量都小于92.4kJ,a<b <92.4正确;B、三个容器内反应的温度相同,对于同一反应,温度不变,化学平衡常数不变,错误;C、①、③相比,③的反应物浓度是①的2倍,所以③相当于在①平衡的基础上又正向移动,所以达平衡时氨气的体积分数:①<③,错误;D、由C分析,①、③相比,N2的转化率③>①;①、②相比,②的氮气的浓度较大,氢气浓度相等,根据增大一种反应物的浓度会增大另一种反应物的转化率,而自身转化率降低,所以N2的转化率:①>②,综合起来是③>①>②,错误,答案选A。
本题难度:一般
3、选择题 关于化学反应速率的影响因素的说法中不正确的是
[? ]
A.改变压强,若不能引起浓度的变化,反应速率就不会受影响
B.决定化学反应速率快慢的主要因素是反应物的性质
C.任何一种加快反应速率的因素都是由于增加了活化分子的百分数
D.反应速率加快的原因是有效碰撞次数增多
参考答案:C
本题解析:
本题难度:一般
4、填空题 (5分)对于反应:CO(g)+H2O(g)  CO2(g)+H2 (g) ΔH>0请回答下列问题:
CO2(g)+H2 (g) ΔH>0请回答下列问题:
(1)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生上述反应,CO和H2O浓度变化如图,则 0~4min内的平均反应速率v(CO)=______ mol/(L·min)

(2)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表。
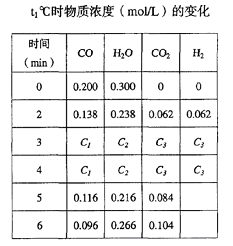
则:
①C1数值___(选填“>”、“<”或“=”)0.08 mol/L。
②反应在4min~5min间,平衡向逆反应方向移动,可能的原因是________(单选);表中5min—6min之间数值发生变化,可能的原因是__________(单选)。
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度
参考答案:(1)0.03(2分)(2)①<(1分)②d(1分)a(1分)
本题解析:(1)一氧化碳的速率=(0.20-0.08)/4=0.03mol/(L·min)。(2)①t℃(高于850℃)时,平衡正向移动,一氧化碳的浓度小于0.08mol/L。②从表中数据可以知道,5分钟时反应物的浓度增大,二氧化碳的浓度减小,说明是增加了氢气的浓度,选d。从5min到6min,可以看到一氧化碳的浓度减小,二氧化碳的浓度增大,说明反应正向移动,但水蒸汽的浓度增大,说明反应时增加了水蒸汽,选a。
考点:化学平衡移动,化学平衡图像分析。
本题难度:困难
5、选择题 下列反应中生成H2的速率最慢的是
[? ]
金属?
酸溶液
温度
A.
Mg?
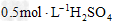
20℃
B.
Fe?

20℃
C.
Mg?

20℃
D.
Mg?

30℃
参考答案:B
本题解析:
本题难度:一般