1、填空题 某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的各种阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
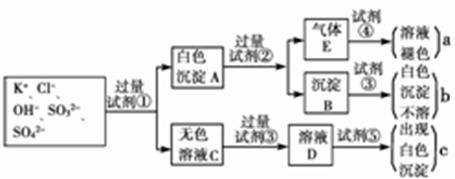 ?
?
(1)图中试剂①~⑤溶质的化学式分别是:
①_________,②__________,③____________,④_________,⑤_________________。
(2)图中现象a、b、c表明检验出的离子分别是:A____________、b____________、c_______________。
(3)白色沉淀A加试剂②反应的离子方程式是_________________________。
(4)无色溶液C加试剂③的主要目的是___________________________。
(5)白色沉淀A若加试剂③而不加试剂②,对实验的影响是__________________________。
(6)气体E通入试剂④发生反应的离子方程式是____________________________________。
参考答案:(1)Ba(NO3)2? HCl? HNO3? Br2? AgNO3?(2) SO32-、SO42-、Cl-
(3)BaSO3+2H+=Ba2++SO2↑+H2O? (4)中和OH-,防止对Cl-的检验产生干扰
(5)会使SO32-对SO42-的检验产生干扰,不能确定SO32-和SO42-是否存在 (6)SO2+Br2+2H2O=4H++ SO42-+2Br-
本题解析:根据白色沉淀A和试剂②反应有气体E生成可知,A中含有亚硫酸盐,E应该是SO2,所以试剂①是硝酸钡。则A中含有硫酸钡和亚硫酸钡。试剂②是盐酸,不能用硝酸,因为硝酸具有强氧化性。SO2能使试剂④褪色,说明试剂④应该是溴水。B是硫酸钡,不能溶于酸中,则试剂③是硝酸。C中含有氯离子、钾离子以及OH-,而OH-能干扰氯离子的检验,所以要先加入硝酸中和碱,然后再加入硝酸银溶液检验氯离子,即试剂⑤是硝酸银。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,难易适中,侧重对学生能力的培养和方法的指导。有助于培养学生规范、严谨的实验设计能力,提高学生的综合实验能力,提升学生的学科素养。该类试题重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:一般
2、推断题 A、B、C为三种重要的工业原料,焰色反应均为黄色,其中A常用来制糕点,B可用来去除油污,他们之间的转化关系如下
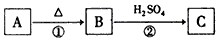
请回答:
(1)反应①的化学方程式是__________________。
(2)B的水溶液中c(H+)______c(OH-)(填“>”或“<”),原因是____________(用离子方程式表示) 。
(3)在B的水溶液中滴加BaCl2溶液后有白色沉淀生成。将所得沉淀分成两份,一份中滴加过量HNO3,现象是__________________,反应的离子方程式是__________________;另一份中先加入过量C的溶液后,充分振荡,过滤后在滤渣中再滴加过量的HNO3,滤渣不溶解,反应的离子方程式是____________。
参考答案:(1)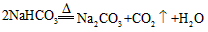
(2)<;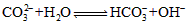
(3)白色沉淀溶解,有气泡产生;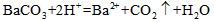 ;
;
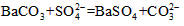
本题解析:
本题难度:一般
3、推断题 A、B、C、D、E、F六种常见的单质或化合物在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均已给出。
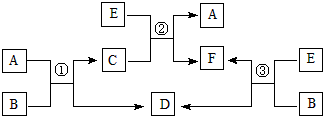
(1)若B在常温下为液态;C是一种有磁性的化合物;E是一种无色、无味的有毒气体。则反应③的化学方程式______________。
(2)若B由两种元素组成,其简单离子的电子层结构相同;绿色植物的光合作用和呼吸作用可实现自然界中D、E的循环。则B的电子式为_________________,11.6gA和E组成的混合气体与足量的B固体反应,固体增重3.6g,则A、E混合气中E 的体积分数为_________________________。
(3)若A和E都是第四周期常见的金属单质,其余都是常见的盐,反应①②③都在溶液中进行,则B、C、F氧化性由强到弱顺序为(用离子符号表示)_________________。
参考答案:(1)CO+H2O CO2+H2
CO2+H2
(2)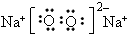 ;20%
;20%
(3)Fe3+>Cu2+>Zn2+
本题解析:
本题难度:一般
4、简答题 如图中A∽E均为中学化学中常见的物质,它们之间有如下转化关系.其中A、D为金属单质.C是两性氧化物,B为红棕色粉末(反应过程中生成的水及其他产物已略去)
请回答以下问题:
(1)B是______,C是______.(填化学式)
(2)写出E与NaOH溶液反应的实验现象______.
(3)A在常温下也可与NaOH溶液反应,写出此反应的化学方程式______.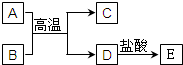
参考答案:C是两性氧化物,应为Al2O3,B为红棕色粉末,应为Fe2O3,则A和B的反应为铝热反应,A为Al,D为Fe,则E为FeCl2,
(1)由以上分析可知,B为Fe2O3,C为Al2O3,故答案为:Fe2O3;Al2O3;
(2)为FeCl2,加入NaOH溶液,生成Fe(OH)2,为白色沉淀,Fe(OH)2不稳定,易被氧化为红褐色Fe(OH)3,现象为产生白色沉淀,迅速变成灰绿色,最终变成红褐色,
故答案为:产生白色沉淀,迅速变成灰绿色,最终变成红褐色;
(3)A为Al,可与NaOH反应生成氢气,反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
本题解析:
本题难度:一般
5、简答题 用右图所示装置进行实验,将A逐滴加入B中;
(1)若A为浓硫酸,B为第三周期金属元素的片状单质,其在常温下难与水反应;C为品红溶液,实验中观察到溶液褪色,则B是______(写化学式),B与浓H2SO4反应的化学方程式为______;反应后往烧杯中加入沸水,又可观察到试管C中的现象为______.
(2)若B为Na2CO3,C为C6H5ONa溶液,实验中观察到小试管内溶液变浑浊,则酸A应具有的性质是______.然后往烧杯中加入沸水,可观察到试管C中的现象是______.
(3)若B是生石灰,实验中观察到C溶液先形成沉淀,然后沉淀溶解,当溶液恰好澄清时,关闭E,然后往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是______(写名称),C是______(写化学式)与葡萄糖的混合液.该反应的离子方程式为______,仪器D在此实验中的作用是______.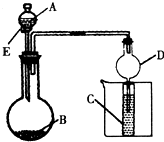
参考答案:(1)由题意可知,B为第三周期金属元素的片状单质,其在常温下难与水反应,B可能为铝活着镁,但浓硫酸常温下会使铝钝化,所以B只能为镁,与浓硫酸发生氧化还原反应,反应的方程式为Mg+2H2SO4(浓)=MgSO4+SO2↑+2H2O,SO2具有漂白性,可使品红褪色,但不稳定,加热又能恢复到原来的颜色,
故答案为:Mg;Mg+2H2SO4(浓)=MgSO4+SO2↑+2H2O;C中溶液变红;
(2)观察到小试管内溶液变浑浊,说明生成二氧化碳,则A的酸性应比碳酸的酸性强,生成苯酚易溶于热水,加热溶液变澄清,
故答案为:酸性比碳酸的酸性强;溶液由浑浊变澄清;
(3)试管壁出现光亮的银镜,说明生成氨气,可用浓氨水或铵盐的浓溶液与生石灰反应制取,C中应为葡萄糖与银氨溶液的反应,则C中应为AgNO3和葡萄糖的混合液,加热时发生:CH2OH(CHOH)4CHO+2[Ag(NH3)2]++2OH-水溶
本题解析:
本题难度:一般