1、填空题 (12分)按下图装置进行实验,并回答下列问题
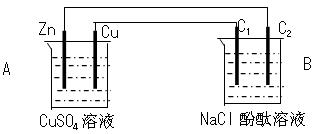
(1)判断装置的名称:A池为___________ , B池为______________
(2)锌极为__________极,电极反应式为_______________ __________
(3)石墨棒C1为______极,电极反应式为__________ _____________
石墨棒C2附近发生的实验现象为________________ ____________
(4)当C2极析出224mL气体(标准状态)时,锌的质量减少_________g。
参考答案:(12分)
(1)原电池,电解池
(2)负 Zn - 2e- = Zn2+ (3)阳 2 Cl- - 2e- = Cl2↑
电极上有气泡产生,无色溶液变红色 (4)0.65
本题解析:略
本题难度:简单
2、填空题 家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,某同学拟对其原理及条件进行分析:
(1)该同学准备了下列实验用品:20% NaCl溶液、蒸馏水、酚酞试液、KSCN溶液、新制氯水、纯铁丝、碳棒、U形管、导线等;请你帮他设计一个实验方案来验证钢铁吸氧腐蚀的电极产物,简述操作过程并写出溶液中有关反应的离子方程式。
(2)将一铜棒、碳棒用导线连接后,插入内盛20%氯化钠溶液的U形管中,请根据此装置在下列两项中择一
回答:
①若不是原电池,请说明原因: (如果回答此题,下面的②不用回答)。
②若是原电池,现要求利用此装置(电极材料、溶液浓度均不变),采取适当的措施来提高电池的放电效率,该操作可以是: 。
(3)目前我国许多大型铜质文物露天放置腐蚀严重,在不影响观瞻效果的条件下,除用加保护层法保护外,请你再提出一项简单而有效的保护方法并简述其保护原理: 。
参考答案:(1)用导线连接纯铁丝和碳棒后插入盛有20% NaCl溶液的U形管中,放置数分钟,向插入纯铁丝的一端滴入1~2滴KSCN溶液未显色,再滴入氯水显(血)红色,证明负极有Fe2+生成,相关离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;Fe3++3SCN-=Fe(SCN)3。向插入碳棒的一端滴入酚酞溶液,溶液显红色,证明有OH-生成
(2)②向插入碳棒的溶液中通入氧气或空气
(3)将铁块(或锌块)连接文物底座并埋入地下,定期更换;原理是:使文物成为原电池的正极(或使铜文物用导线连接直流电源的负极,正极用导线连接埋入地下的导体;原理是:使文物成为电解池的阴极)
本题解析:(1)为加速腐蚀,应选用20% NaCl溶液为电解质溶液,以纯铁丝和碳棒作两极,分别针对两极产物Fe2+和OH-进行检验。(2)具备构成原电池的基本条件,所以是原电池,在正极上发生还原反应的是空气中的O2,要加快反应速率,可增大O2浓度。(3)在众多限制下,可考虑电化学保护法。
本题难度:一般
3、填空题 Ⅰ.电离平衡常数(用K表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
化学式
| HF
| H2CO3
| HClO
|
电离平衡常数
(K)
| 7.2×10-4
| K1=4.4×10-7
K2=4.7×10-11
| 3.0×10-8
|
?
(1)物质的量浓度均为0.1mol/L的下列四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是______________。
(2)25℃时,在20mL0.1mol·L—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_______。
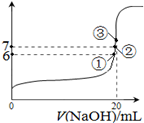
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol·L—1
(3)已知25℃时,①HF(aq)+OH-(aq)=F-(aq)+H2O(l)? ΔH=-akJ·mol—1,
②H+(aq)+OH-(aq)=H2O(l)? ΔH=-bkJ·mol—1,
氢氟酸的电离方程式及热效应可表示为________________________。
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与等物质的量的H2O反应得到HF和化合物A,则每生成1molHF转移_______mol电子。
Ⅱ.氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点–54.1℃,沸点69.1℃。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
SO2(g)+Cl2(g) SO2Cl2(l) ?△H=–97.3kJ·mol—1
SO2Cl2(l) ?△H=–97.3kJ·mol—1
(1)试写出常温常压下化学平衡常数K的表达式:K=_________________;
(2)对上述反应,若要使化学平衡常数K增大,化学反应速率v正也增大,可采取的措施是_____(选填编号)。
a.降低温度?b.移走SO2Cl2
c.增加反应物浓度?d.无法满足上述条件
(3)下列描述中能说明上述反应已达平衡的是____________(选填编号)。
a.υ(Cl 2)=υ(SO2)? b.容器中气体压强不随时间而变化?
c.c(Cl 2) : c(SO2)=1:1? d.容器中气体颜色不随时间两变化
(4)300℃时,体积为1L的密闭容器中充入16.20g SO2Cl2,达到平衡时容器中含SO2 7.616g。若在上述中的平衡体系中,再加入16.20g SO2Cl2,当再次达平衡时,容器中含SO2的质量范围是________________________。
参考答案:Ⅰ. (1)①④②③(或①>④>②>③,用物质名称表示也对)(2分) (2)BC(2分)
(3)HF(aq) 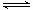 H+(aq) +F—(aq) △H=-(a-b)KJ·mol—1(2分,不写可逆号扣1分)
H+(aq) +F—(aq) △H=-(a-b)KJ·mol—1(2分,不写可逆号扣1分)
(4)1(2分)
Ⅱ.(1)K= (2分) 2)d(2分)(3)bd(2分)
(2分) 2)d(2分)(3)bd(2分)
(4)7.616g<m(SO2)<15.232g(2分)
本题解析:Ⅰ.(1)根据越弱越水解,电离常数越小,盐水解时碱性越强,碳酸的二级电离常数最小,所以①碱性最强,其次是④,再次是②,最小是③;(2)A、HF溶液中对水的电离起抑制作用,NaF溶液中对水的电离起促进作用,因此由水电离出的c(H+)不相等,错误;B、①点时pH=6,根据电荷守恒C(Na+)+C(H+)=C(F-)+C(OH-),c(F-)-c(Na+)= C(H+)- C(OH-)=10-6-10-8=9.9×10-7mol/L,正确;C、②点时,pH=7,溶液呈中性,C(H+)=C(OH-),因此溶液中的c(F-)=c(Na+),正确;D、③点时V=20mL,恰好完全反应得到NaF溶液,c(F-)<c(Na+)=0.05mol·L—1,错误,选择BC;(3)根据盖斯定律,①-②可得HF(aq) 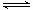 H+(aq) +F—(aq) △H=-(a-b)KJ·mol—1(4)H—O—F中F非金属性强,共用电子对偏向它,带负电荷-1,H带正电荷+1,O显0价,HFO+H2O=HF+H2O2,生成1molHF转移1摩尔电子。Ⅱ.(2)该反应是放热反应,要使K增大,只能降低温度,降温反应速率降低,所以选d;(3)a、υ(Cl 2)=υ(SO2)在任何条件下都相等,错误;b、方程左右两边气体分子系数差不等0,所以压强不再改变说明气体物质的量不再变化,达到平衡,正确;c、二者浓度1:1,不能说明它的浓度不再发生变化,错误;d、氯气有颜色,颜色不变,说明浓度不再发生变化,说明达到平衡,正确。(4)平衡体系中,再加入16.20g SO2Cl2,浓度变为原来的2倍,等于增大压强,平衡正向移动,但是不能抵消改变,所以比原来的大,但比2倍的少,7.616g<m(SO2)<15.232g
H+(aq) +F—(aq) △H=-(a-b)KJ·mol—1(4)H—O—F中F非金属性强,共用电子对偏向它,带负电荷-1,H带正电荷+1,O显0价,HFO+H2O=HF+H2O2,生成1molHF转移1摩尔电子。Ⅱ.(2)该反应是放热反应,要使K增大,只能降低温度,降温反应速率降低,所以选d;(3)a、υ(Cl 2)=υ(SO2)在任何条件下都相等,错误;b、方程左右两边气体分子系数差不等0,所以压强不再改变说明气体物质的量不再变化,达到平衡,正确;c、二者浓度1:1,不能说明它的浓度不再发生变化,错误;d、氯气有颜色,颜色不变,说明浓度不再发生变化,说明达到平衡,正确。(4)平衡体系中,再加入16.20g SO2Cl2,浓度变为原来的2倍,等于增大压强,平衡正向移动,但是不能抵消改变,所以比原来的大,但比2倍的少,7.616g<m(SO2)<15.232g
本题难度:困难
4、填空题 (8分)根据下式所示的氧化还原反应设计一个原电池:Cu + 2Ag+ =Cu2+? +? 2Ag
(1)装置可采用烧杯和盐桥,画出此原电池的装置简图;
(2)注明原电池的正极和负极,以及外电路中电子流向;
(3)写出两个电极上的电极反应式;
参考答案:略
本题解析:略
本题难度:困难
5、选择题 下列装置图或曲线图与对应的叙述相符的是
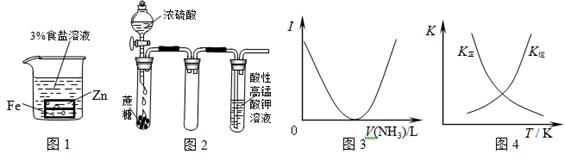
A.图1:负极反应是Fe-2e-=Fe2+
B.图2:酸性KMnO4溶液中没有气泡出现,但溶液颜色会逐渐变浅乃至褪去
C.图3:可表示乙酸溶液中通入氨气至过量过程中溶液导电性(I )的变化
D.图4:可表示在恒容密闭容器中反应“2SO2(g) +O2(g) 2SO3(g) ΔH<0”的平衡常数K正、K
2SO3(g) ΔH<0”的平衡常数K正、K