1、选择题 以下反应属于吸热反应的是:
A.锌与稀硫酸的反应
B.氯化铵与氢氧化钡晶体反应
C.煤的燃烧
D.氢氧化钠与盐酸的反应
参考答案:B
本题解析:A.锌与稀硫酸的反应是置换反应,也是放热反应。错误。B.氯化铵与氢氧化钡晶体反应是复分解反应,是吸热反应。正确。C.煤的燃烧是氧化还原反应,是放热反应。错误。D.氢氧化钠与盐酸的反应是中和反应,同时也是放热反应。错误。
本题难度:一般
2、选择题 测定稀盐酸和氢氧化钠稀溶液中和热的实验中没有使用的仪器有:①大、小烧杯;②容量瓶;③量筒;④环形玻璃搅拌棒;⑤试管;⑥温度计;⑦蒸发皿;⑧托盘天平中的( )
A.①②⑥⑦
B.②⑤⑦⑧
C.②③⑦⑧
D.③④⑤⑦
参考答案:B
本题解析:本题主要考查中和热测定实验中仪器的使用问题,该实验中用到大、小烧杯、温度计、量筒、环形玻璃搅拌棒,没有用到容量瓶、试管、蒸发皿和托盘天平,故B项正确。
本题难度:一般
3、填空题 能源短缺是人类社会面临的重大问题,世界各国都在努力寻找新能源,探求绿色能源的开发。甲醇是一种可再生能源,是一种污染性较小,热值较大的能源,因而具有广泛的开发价值和良好的应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:
反应Ⅱ: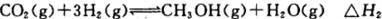
①上述反应符合“原子经济”原则的是_________(填“I’’或“Ⅱ”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)

由表中数据判断△H1_________0(填“>”、“=”或“<”),说明生成物的总能量一定_______(填“>”、“=”或“<”)反应物的总能量。
③反应Ⅱ反应历程如下图,回答下列问题;在反应体系中加入催化剂,反应速率增大,E1、E2和△H2的变化是:E1_________、E2_________、△H2_________(填“增大”“减小”“不变”)。

(2)最新研制的一种新型甲醇电池示意图如图,电池的两极分别充人甲醇和氧气(池内为酸性介质)。则电池工作时____________(填a或b)为正极,a极的电极反应式为______________。

参考答案:(1)①Ⅰ ②<?<?③减小?减小?不变(2)b? CH3OH+H2O—6e—=CO2+6H+。
本题解析:(1)①原子经济性原则是指原子利用率高,Ⅰ是化合反应,原子利用率高达100%,答案为:Ⅰ;②根据表中数据可以看出,温度越高平衡常数越小,可以确定该反应是放热反应,△H1<0,说明生成物的总能量一定小于反应物的总能量;③使用催化剂能降低反应的活化能,但不能改变反应的始终态,不能改变反应的焓变,答案为:减小、减小、不变;(2)在燃料电池中,正极是通入氧气的电极,发生得电子的还原反应,即O2+2H2O+4e-=4OH-,答案为:b;a极为通入甲醇的电极,电极反应式为CH3OH+H2O—6e—=CO2+6H+。
本题难度:一般
4、简答题 某同学进行如下实验,探究化学反应中的能量变化.通过实验测出,反应前后①烧杯中的温度升高,②烧杯中的温度降低.由此判断NaOH溶液跟盐酸的反应是______(填“吸热”或“放热”)反应,Ba(OH)2?8H2O跟NH4Cl的反应是______(填“吸热”或“放热”)反应.试写出①中反应的离子方程式______.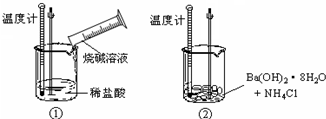
参考答案:通过实验测出,反应前后①烧杯中的温度升高,②烧杯中的温度降低,根据温度升高,反应放热,温度降低、反应吸热,所以NaOH溶液跟盐酸的反应是放热反应,Ba(OH)2?8H2O跟NH4Cl的反应是吸热反应,NaOH溶液跟盐酸反应方程式为:HCl+NaOH=NaCl+H2O,实质是:H++OH-=H2O.
故答案为:放热;吸热;H++OH-=H2O.
本题解析:
本题难度:一般
5、选择题 已知 (1)? H2(g)+1/2O2(g)=H2O(g)?△H1=a kJ/mol
(2)2H2(g)+O2(g)=2H2O(g)?△H2=b kJ/mol
(3)H2(g)+1/2O2(g)=H2O(l)?△H3=c kJ/mol
(4)2H2(g)+O2(g)=2H2O(l)?△H4=d kJ/mol
下列关系式中正确的是?(?)
A.a<c<0
B.b>d>0
C.2a=b<0
D.2c=d>0
参考答案:C
本题解析:氢气燃烧是放热反应,△H小于0。由于气态水的能量高于液态水的能量,所以氢气燃烧生成液态水放出的能量多,但放热越多,反应热越小,所以选项C正确,其余都是错误的,答案选C。
本题难度:简单