1、选择题 某溶液中可能含有Mg2+、Al3+、SO42-、I-,分别取样进行如下实验:
①加入氯水时,溶液呈黄色,再加入BaCl2溶液,产生不溶于稀盐酸的白色沉淀;
②加入过量的NaOH溶液,产生白色沉淀.
则下列离子中不能确定其是否存在的是
A.Mg2+
B.Al3+
C.SO42-
D.I-
参考答案:B
本题解析:分析:①加入氯水时,溶液呈黄色,证明有单质碘出现,再加入BaCl2溶液,产生不溶于稀盐酸的白色沉淀,可以是硫酸钡沉淀;
②加入过量的NaOH溶液,产生白色沉淀,只能是氢氧化镁,证明含有镁离子.
解答:①加入氯水时,溶液呈黄色,证明含有碘离子,碘离子被氯气氧化为碘单质,再加入BaCl2溶液,产生不溶于稀盐酸的白色沉淀,只能是硫酸钡沉淀,证明含有硫酸根离子;
②加入过量的NaOH溶液,产生白色沉淀,只能是氢氧化镁沉淀,一定会含有镁离子,可能含有铝离子,因为生成的氢氧化铝可以溶于过量的氢氧化钠中.
所以离子中不能确定其是否存在的是铝离子.
故选B.
点评:本题主要考查了根据实验现象判断离子共存,要掌握根据实验现象判断存在的离子,排除与该离子反应的离子.
本题难度:一般
2、选择题 如图为反应2X(g)+Y(s)  ?2Z(g)的反应过程和能量关系图,下列说法正确的是(?)
?2Z(g)的反应过程和能量关系图,下列说法正确的是(?)
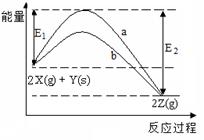
A.曲线a和b表示两个反应过程的反应热不同
B.曲线a一定表示反应是在无催化剂时的反应过程
C.增大压强,X的转化率一定增大
D.反应达到平衡后,升高温度,平衡常数K值一定减小
参考答案:D
本题解析:由盖斯定律知,反应热由始态和终态决定,a和b的初始态和终态一样,故反应热相同;影响反应过程的因素很多,有温度、压强、催化剂等,B中曲线a与b可能使用不同的催化剂所致。
本题难度:一般
3、选择题 下列说法正确的是(?)
A.离子化合物中只能含有离子键
B.共价化合物中只能含有共价键
C.活泼金属元素和非金属元素之间一定以离子键结合
D.化学键不仅存在于原子之间,也存在于分子之间
参考答案:B
本题解析:A选项中离子化合物中除含有离子键之外,还可能含有共价键;B选项中共价化合物只存在共价键,没有离子键;C选项中活泼金属与非金属元素之间也可以以共价键结合,如AlCl3、BeCl2等;D选项中化学键只存在于原子之间或阴阳离子之间,分子之间的相互作用属于分子间作用力。
本题难度:简单
4、选择题 下列叙述中,正确的是
A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.晶体中只要有阴离子就一定有阳离子
D.金属原子失去电子变成稳定结构时吸收的能量越多,则该原子金属性越强。
参考答案:C
本题解析:A:硫离子与钾离子的核外电子排布完全相同,但前者只有还原性,后者只有氧化性;
B:Fe2+的核外最外层电子数为14;
D:金属原子失去电子变成稳定结构时吸收的能量越小,则越易失电子,则该原子金属性越强
本题难度:一般
5、选择题 在同温同压下,下列各组热化学方程式中,△H2>△H1的是
A.2H2(g)+O2(g)=2H2O(g) △H1;2H2(g)+O2(g)=2H2O(l)△H2
B.S(g)+O2(g)=SO2(g)△H1;S(s)+O2(g)=SO2(g)△H2
C.C(s)+ O2(g)=CO(g)△H1;C(s)+O2(g)=CO2(g)△H2
O2(g)=CO(g)△H1;C(s)+O2(g)=CO2(g)△H2
D.H2(g)+Cl2(g)=2HCl(g)△H1;2H2(g)+2Cl2(g)=4HCl(g)△H2