| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《化学平衡》试题预测(2020年最新版)(八)
参考答案: 本题解析: 本题难度:一般 2、填空题 (12分)(1)已知反应Ⅰ:4NH3(g)+3O2(g)==2N2(g)+6H2O(g) △H=-1266.8kJ/mol |
参考答案:(12分)
(1)①4NH3(g)+5O2(g)==4NO(g)+6H2O(g) △=-905.8kJ/mol (2分) , K1·K22 (2分)
②2NH3-6e-+6OH- ==N2+6H2O (2分) 升高(2分)
(2)①AD (2分) ②40%(2分)
本题解析:(1)①根据盖斯定律,反应I+2倍反应II,可得到氨高温催化氧化生成NO的热化学方程式,为4NH3(g)+5O2(g)==4NO(g)+6H2O(g) △=-905.8kJ/mol;因为该反应=反应I+2倍反应II,所以该反应的平衡常数K=K1·K22;
②反应I设计为原电池,则氨气作负极,氧气作正极,所以负极的氨气失去电子,与氢氧根离子结合,生成氮气和水,电极反应式是2NH3-6e-+6OH- ==N2+6H2O;正极是氧气得到电子,与水结合生成氢氧根离子,所以正极附近pH升高;
(2)①提高氢气的转化率,则可以及时移出氨,生成物的浓度减小,平衡正向移动;而升高温度,平衡逆向移动,氢气的转化率降低;使用催化剂,对平衡的移动无影响,氢气的转化率不变;循环利用和不断补充氮气,则使平衡正向移动,氢气的转化率增大,所以答案选AD;
②当氨气的体积分数是25%时,设消耗氮气的体积是x,则消耗氢气的体积是3x,生成氨气的体积是2x,所以2x/(1-x+3-3x+2x)=25%,解得x=0.4,则氢气的转化率是3×0.4/3×100%=40%。
考点:考查盖斯定律的应用,化学平衡移动的判断,转化率的计算,电化学反应原理的应用
本题难度:一般
3、选择题 反应A+2B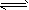 2C(g);正反应为放热反应。当反应达到平衡后,同时升高温度和减小压强达到新的平衡,若新平衡时混合物C的含量与原平衡相同,则下列推断正确的是
2C(g);正反应为放热反应。当反应达到平衡后,同时升高温度和减小压强达到新的平衡,若新平衡时混合物C的含量与原平衡相同,则下列推断正确的是
[? ]
A.B一定不是气态物质
B.A一定不是气态物质
C.达到新平衡后升高温度,正反应速率减慢,逆反应速率加快
D.达到新平衡后加入B,平衡向正反应方向移动
参考答案:A
本题解析:
本题难度:一般
4、填空题 (14分)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
①CO(g)+H2O(g)  CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
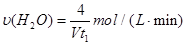
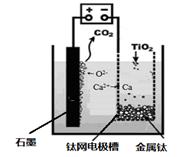
参考答案:(1)小于;(2)80%。;(3)1 (4)A;(5)2CO(g) + O2(g) ="==" 2CO2(g) △H =" -566" kJ/mol
(6)3CO2 + 5OH- ="==" 2CO32- + HCO3- + 2H2O
(7)① 2O2- - 4e- ="=" O2↑或 C + 2O2- - 4e- ="=" CO2↑
②制备TiO2时,在电解槽发生如下反应:2CaO  2Ca + O2↑, 2Ca + TiO2
2Ca + O2↑, 2Ca + TiO2 Ti + 2CaO,
Ti + 2CaO,
由此可见,CaO的量不变。
或: 制备TiO2时,在电解槽发生如下反应:阴极:2Ca2+ + 4e- ="=" 2Ca ;阳极:2O2- - 4e- ="=" O2↑
2Ca + TiO2 Ti + 2CaO,,由此可见,CaO的量不变。
Ti + 2CaO,,由此可见,CaO的量不变。
本题解析:(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量小于生成物分子化学键形成时所释放的总能量,所以发生化学反应时放出热量。(2)容器①中反应达平衡时,32.8 kJ ÷41 kJ =0.8,所以CO的转化率为80%;(3)由于容器①、容器②中的温度不变,所以反应的平衡常数相同。K=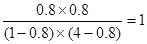 ;(4)A. 由于该容器内的反应是反应前后气体体积相等的反应,两个容器内反应物的物质的量的比相等,所以达到平衡时,两容器中为等效平衡,故H2的体积分数相等,正确;B.由于容器容器①、②是等效平衡,所以物质的量是①的2倍,放出的热量也是①的2倍,所以②中反应达平衡状态时,Q ="32.8" kJ×2=" 65.6" kJ;错误;C.反应开始时,由于②的物质的量是①的2倍,浓度越大,反应速率就越快,错误;D.化学反应速率是单位时间内物质的量浓度的改变数值,该反应是可逆反应,反应物不可能完全反应,故该选项错误。①×2+②整理可得:2CO(g) + O2(g) ="==" 2CO2(g) △H =" -566" kJ/mol;(6)n(CO2)="0.6" mol ;n(NaOH)=" 0.200L" ×5 mol/L=1mol,则n(CO2):n(NaOH)=3:5,所以化学方程式是:3CO2 + 5OH- ="==" 2CO32- + HCO3- + 2H2O;(7)①在阳极O2-失去电子,发生氧化反应,所发生反应的电极反应式是:2O2- - 4e- ="=" O2↑或写为C + 2O2- - 4e- ="=" CO2↑;②在制备金属钛前后,CaO的总量不变,其原因是制备TiO2时,在电解槽发生如下反应:阴极:2Ca2+ + 4e- ="=" 2Ca ;阳极:2O2- - 4e- ="=" O2↑;2Ca + TiO2
;(4)A. 由于该容器内的反应是反应前后气体体积相等的反应,两个容器内反应物的物质的量的比相等,所以达到平衡时,两容器中为等效平衡,故H2的体积分数相等,正确;B.由于容器容器①、②是等效平衡,所以物质的量是①的2倍,放出的热量也是①的2倍,所以②中反应达平衡状态时,Q ="32.8" kJ×2=" 65.6" kJ;错误;C.反应开始时,由于②的物质的量是①的2倍,浓度越大,反应速率就越快,错误;D.化学反应速率是单位时间内物质的量浓度的改变数值,该反应是可逆反应,反应物不可能完全反应,故该选项错误。①×2+②整理可得:2CO(g) + O2(g) ="==" 2CO2(g) △H =" -566" kJ/mol;(6)n(CO2)="0.6" mol ;n(NaOH)=" 0.200L" ×5 mol/L=1mol,则n(CO2):n(NaOH)=3:5,所以化学方程式是:3CO2 + 5OH- ="==" 2CO32- + HCO3- + 2H2O;(7)①在阳极O2-失去电子,发生氧化反应,所发生反应的电极反应式是:2O2- - 4e- ="=" O2↑或写为C + 2O2- - 4e- ="=" CO2↑;②在制备金属钛前后,CaO的总量不变,其原因是制备TiO2时,在电解槽发生如下反应:阴极:2Ca2+ + 4e- ="=" 2Ca ;阳极:2O2- - 4e- ="=" O2↑;2Ca + TiO2 Ti + 2CaO,,由此可见,CaO的量不变。
Ti + 2CaO,,由此可见,CaO的量不变。
考点:考查化学键的键能与反应热的关系、物质的平衡转化率、平衡状态的判断、离子方程式的书写、电解原理的应用的知识。
本题难度:困难
5、选择题 某温度下,在固定容积的容器中,可逆反应A(g)+3B(g)═2C(g)达到平衡,此时测得n(A):n(B):n(C)=2:2:1.若保持温度不变,以n(A):n(B):n(C)=2:2:1的比例向该容器中再充入A、B和C,则( )
A.平衡向正反应方向移动
B.平衡向逆反方向移动
C.平衡不发生移动
D.n(C)减小
参考答案:达到平衡,此时测得n(A):n(B):n(C)=2:2:1.若保持温度不变,以n(A):n(B):n(C)=2:2:1的比例向该容器中再充入A、B和C,相当于在原来的基础上缩小体积,增大压强,反应前气体的化学计量数之和大于生成物的气体化学计量数之和,则增大压强,平衡向正反应方向移动,故A正确、B、C错误;
增加C的物质的量,平衡虽然向正反应方向移动,根据勒沙特列原理可知,只能减弱、但不能改变,则C的物质的量增大,故D错误.
故选A.
本题解析:
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《探究性实验.. | |