1、简答题 氨在国民经济中占有重要的地位,请参与下列探究.
(1)合成氨反应N2(g)+3H2(g)?2NH3(g),该反应为放热反应,若在恒温、恒压条件下向平衡体系中通入氩气,则平衡______移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H______(填“增大”“减小”或“不改变”).
(2)已知在400℃时,N2(g)+3H2(g)?2NH3(g)的K=0.5,则①2NH3(g)?N2(g)+3H2(g)的K=______(填数值).
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为4mol、2mol、4mol;则此时反应v(N2)正______v(N2)逆(填:“>”、“<”、“=”或“不能确定”)
(3)在三个相同容器中各充入1molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如图.下列说法正确的是______(填序号).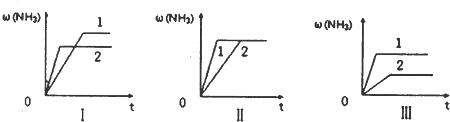
A.图Ⅰ可能是不同压强对反应的影响,且P2>Pl
B.图Ⅱ可能是不同压强对反应的影响,且Pl>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能,1>2.
参考答案:(1)恒压条件下向平衡体系中通入氩气,体积增大,平衡向逆方向移动;加入催化剂,只改变反应的活化能,但反应热不变,故答案为:向左;不改变;
(2)①反应2NH3(g)?N2 (g)+3H2(g)和反应N2 (g)+3H2(g)?2NH3(g)是互为可逆反应,平衡常数互为倒数,故此反应的平衡常数是2,故答案为:2;
②一段时间后,当N2、H2、NH3的物质的量分别为2mol/L、1mol/L、2mol/L时,Qc=4×44×23=0.5,所以该状态是平衡状态,正逆反应速率相等,故答案为:=;
(3)A.增大压强平衡右移,氨气的含量应增大,故A错误;
B.压强不同,平衡状态不同,不可能在同一平衡状态,故B错误;
C.升高温度平衡逆向移动,氨气的含量减小,故C错误;
D.催化剂不影响平衡移动,由图象可知催化剂性能,1>2,故D正确.
故答案为:D.
本题解析:
本题难度:一般
2、选择题 在一定条件下某体积一定的密闭容器中发生的反应aA(g)+bB(g) xC(g)符合下图甲所示关系(c%表示平衡混合气体中C的百分含量,T表示温度,p表示压强)。则图乙中纵轴y是指
xC(g)符合下图甲所示关系(c%表示平衡混合气体中C的百分含量,T表示温度,p表示压强)。则图乙中纵轴y是指
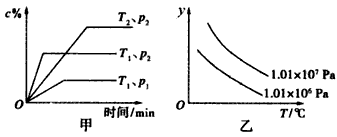
[? ]
A.平衡混合气的密度
B.平衡混合气中B的百分含量
C.平衡混合气的总物质的量
D.平衡混合气的平均相对分子质量
参考答案:D
本题解析:
本题难度:一般
3、填空题 请回答下列有关问题:
(1)现代工业将煤汽化,既可以提高燃料的利用率、减少CO、SO2等的排放,又可以扩大水煤气的用途。
①已知:2C(s)+O2(g)=2CO(g);ΔH1,2H2(g)+O2(g)=2H2O(g);ΔH2 。
则反应C(s)+H2O(g)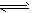 CO(g)+H2(g);ΔH=_____________________。(用含ΔH1、ΔH2的代数式表示)
CO(g)+H2(g);ΔH=_____________________。(用含ΔH1、ΔH2的代数式表示)
②CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)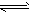 CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
CH3OH(g);ΔH3。现在容积均为1L的a、b、c、d、e五个密闭容器中分别充入1mol CO和2mol H2的混合气体,控温,进行实验,测得相关数据如下图1和图2。
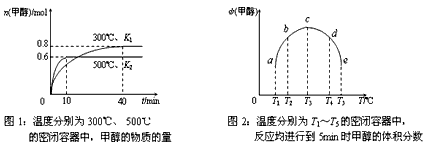
a. 该反应的ΔH3________0(选填“<”、“>”或“=”,下同),K1__________K2。 b. 将容器d中的平衡状态转变到容器c中的平衡状态,可采取的措施有___________________________。
(2)某燃料电池以熔融态K2CO3为电解质,一极通入CO,另一极通入空气和CO2的混合气体。已知该燃料电池正极反应为2CO2+O2+4e-=2CO32-;则其负极的电极反应式为_____________________________。
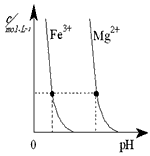
(3)煤汽化后的煤渣可以提炼重金属。下图为某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度变化情况。据图分析:该温度下,溶度积常数的关系为:Ksp[ Fe(OH)3]____________Ksp[Mg(OH)2] (填:>、=、<);如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是_____________________________。
参考答案:(1)①(ΔH1-ΔH2)/2②a. <;> b. 降温、增(或加)压
(2)CO+CO32--2e-=2CO2
(3)<;由于Ksp[ Fe(OH)3] <Ksp[Mg(OH)2] ,浊液中存在溶解平衡:Mg(OH)2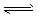 Mg2++2OH-,当加入Fe3+后与OH-生成更难溶解的Fe(OH)3,使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3。
Mg2++2OH-,当加入Fe3+后与OH-生成更难溶解的Fe(OH)3,使平衡继续向右移动,最后Mg(OH)2全部溶解转化为红棕色的Fe(OH)3。
本题解析:
本题难度:一般
4、选择题 一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g)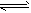 zC(g)(正反应放热),达到平衡后测得A气体的浓度为0.5mol·L-1,当恒温下将密闭容器的容积扩大到原来的两倍并再次达到平衡时,测得A的浓度为0.3mol·L-1。则下列叙述正确的是
zC(g)(正反应放热),达到平衡后测得A气体的浓度为0.5mol·L-1,当恒温下将密闭容器的容积扩大到原来的两倍并再次达到平衡时,测得A的浓度为0.3mol·L-1。则下列叙述正确的是
[? ]
A.平衡向右移动
B.x+y>z
C.B的转化率提高
D.C的体积分数增加
参考答案:B
本题解析:
本题难度:一般
5、选择题 下列措施或事实不能用勒沙特列原理解释的是( )
A.新制的氯水在光照下颜色变浅
B.H2、I2、HI平衡混合气加压后颜色变深
C.工业上生产硫酸的过程中,使用过程过量的空气以提高SO2的利用率
D.在合成氨的反应中,加压有利于氨的合成
参考答案:A.氯水中存在平衡Cl2+H2O?HClO+H++Cl-,光照HClO分解,溶液中HClO浓度降低,平衡向生成HClO方向移动,可用勒夏特列原理解释,故A不选;
B.可逆反应为H2(g)+I2(g)?2HI(g),增大压强I2的浓度增大,颜色加深,反应前后气体的体积不发生变化,增大压强平衡不移动,不能用用勒夏特列原理解释,故B选;
C.增大空气的量,平衡向正反应方向移动,所以可以用平衡移动原理解释,故C不选;
D.合成氨反应为N2(g)+3H2(g)?2NH3 (g)△H<0,正反应为气体体积减小的放热反应,增大压强平衡向体积减小的方向移动,即向正反应移动,有利于氨的合成,可用勒夏特列原理解释,故D不选;
故选B.
本题解析:
本题难度:一般