1、实验题 某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01 mol?L-1、0.001 mol?L-1,?催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.1 mol?L-1)的用量均为2mL。
(1)配平化学方程式:
______KMnO4 +____H2C2O4 +_____H2SO4 → ____K2SO4 +_____MnSO4 +_____CO2 +______H2O
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号
| T/K
| 催化剂的用量/ g
| KMnO4酸性溶液的浓度/mol?L-1
| 实验目的
|
①
| 298
| 0.5
| 0.01
| (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响;
(Ⅱ)实验①和③探究温度对该反应速率的影响;
(Ⅲ)实验①和______探究催化剂对该反应速率的影响
|
②
| ?
| ?
| ?
|
③
| ?
| ?
| ?
|
④
| ?
| 0
| ?
|
(3)在完成探究催化剂对该反应速率影响的实验时发现,未加催化剂的情况下,刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快。
针对上述实验现象,同学认为高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快,从影响化学反应速率的因素看,你猜想还可能是________________
若用实验证明你的猜想。除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是_______
A.硫酸钾? B.硫酸锰? C.二氧化锰? D.水
(4)某同学对实验①和②分别进行三次实验,测得以下实验数据(从混合振荡均匀开始计时):
KMnO4酸性溶液
的浓度?/?mol?L-1
| 溶液褪色所需时间?t / min
|
第1次
| 第2次
| 第3次
|
0.01
| 14
| 13
| 11
|
0.001
| 6
| 7
| 7
|
计算用0.001?mol?L-1?KMnO4酸性溶液进行实验时KMnO4的平均反应速率?(忽略混合前后溶液体积的变化)。
(4)?若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?_________。若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案_____________________________________
参考答案:(11分)(1) 配平化学方程式:(2分,全对才给分)
2KMnO4 +5H2C2O4 +3H2SO4 → 1K2SO4 +2MnSO4 +10CO2 +8H2O
(1)?请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:(每一行1分,共3分)
实验编号
T/K
催化剂的用量/ g
KMnO4酸性溶液的浓度/mol?L-1
实验目的
①
298
0.5
0.01
(Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响;
(Ⅱ)实验①和③探究温度对该反应速率的影响;
(Ⅲ)实验①和④探究催化剂对该反应速率的影响
②
298
0.5
0.001
③
323
0.5
0.01
④
298
0
0.01
(3)生成的Mn2+催化反应的进行(1分),B(1分)
(4)1×10-4mol/L.min (1分)?
(5)不可行(1分)。取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的KMnO4溶液反应(2分)
本题解析:(1)在酸性条件下,高锰酸根离子能和草酸发生氧化还原反应生成二价锰离子、二氧化碳和水,根据电子的得失守恒可知,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。
(2)要得出反应物浓度、温度、催化剂对反应速率影响的结论至少要完成:①取不同浓度KMnO4溶液,在相同温度下进行反应;②取同浓度KMnO4溶液,在不同温度下进行反应;③取同浓度KMnO4溶溶,在同温度且有催化剂的条件下进行反应;④取同浓度KMnO4溶液,在同温度且不使用催化剂的条件下进行反应等3个实验来进行对比。
(3)根据反应的方程式可知,生成物中有Mn2+生成,这说明引起反应速率加快的原因还可能是生成的Mn2+催化反应的进行,据此可知,如果要验证假设,则可以选择试剂硫酸锰,答案选B。
(4)①反应开始时:c(KMnO4)= ,反应时间:△t=(6min+7min+7min)÷3=6.7min,所以KMnO4的平均反应速率ν(KMnO4)=
,反应时间:△t=(6min+7min+7min)÷3=6.7min,所以KMnO4的平均反应速率ν(KMnO4)= 。
。
②由题中数据知浓度大的褪色时间反而长,因颜色是由KMnO4产生,虽然KMnO4浓度大反应快,但KMnO4的量也多,故无法比较,故不经过计算直接利用表中的褪色时间长短来判断浓度大小与反应速率的关系是不可行的;所以若想通过直接观察褪色时间长短来判断溶液浓度的大小,则必须保证KMnO4酸性溶液的浓度相同,才能判断H2C2O4溶液浓度的大小,即取过量的体积相同、浓度不同的草酸溶液分别同时与体积相同、浓度相同的高锰酸钾酸性溶液反应。
点评:该题是高考中的常见题型,所以中等难度的试题。试题综合性强,侧重对学生能力的培养和胶体方法的指导与训练,有利于培养学生规范、严谨的实验设计、评价能力,有利于提高学生的学科素养。该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:一般
2、实验题 根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量Ar(Cu)(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),由此计算Ar (Cu)。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4Cl与Ca(OH)2的量足以产生使CuO完全还原的氨气):

请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为____________________________;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→__________________;
(3)在本实验中,若测得m(CuO)= a g,m(H2O)= b g,则Ar(Cu)= _______________;
(4)在本实验中,使测定结果Ar(Cu)偏大的是_______________ (填序号);
①CuO未完全起反应
② CuO不干燥
③CuO中混有不反应的杂质
④ 碱石灰不干燥
⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定______和_____,或_____和______达到实验目的。
参考答案:(1)2NH3+3CuO 3Cu+3H2O+N2↑
3Cu+3H2O+N2↑
(2)a→e→b→e→e
(3)18a/b-16
(4) ①③
(5) m(CuO)和m(Cu); m(Cu)和m(H2O)
本题解析:
本题难度:一般
3、选择题 某无色气体可能含有CO2、CO、H2、H2O(g)中的一种或几种,依次进行以下处理(每步反应均进行完全)。①通过赤热的炭层后,恢复到原状态,气体体积不变;②通过灼热的CuO时,固体变红色;③通过白色CuSO4粉末时,粉末变蓝色;④通入澄清石灰水中,石灰水变浑浊。下列判断中,正确的是
A.原混合气体中一定没有CO、H2O,一定含有H2和CO2
B.①②③④中都发生了氧化还原反应
C.③中的反应为:CO2+3H2O+2CuSO4 ="===" Cu2(OH)2CO3+2H2SO4
D.由①④说明,实验过程中一定有CO2生成
参考答案:D
本题解析:由①推测一定含CO,由②推测含H2,由③推测可能含H2O(g),因为在②中也生成H2O,由④推测可能含CO2,因为在①中也可生成CO2在④中观察到现象。
本题难度:简单
4、推断题 汽车安全气囊是行车安全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的粉末进行实验。经组成分析,确定该粉末仅Na、Fe、N、O四种元素。水溶性试验表明,固体粉末部分溶解。经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸。取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另和一种单质。化合物丙与空气接触可转化为可溶性盐。
请回答下列问题:
(1)甲的化学式为_____________,丙的电子式为_____________。
(2)若丙在空气中转化为碳酸氢盐,则反应的化学方程式为________________________。
(3)单质乙与红棕色粉末发生反应的化学方程式为__________________________,安全气囊中红棕色粉末的作用是__________________________。
(4)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是_____________。
A.KCl B.KNO3 C.Na2S D.CuO
(5)设计一个实验方案,探究化合物丙与空气接触后生成可溶性盐的成分(不考虑结晶水合物)
_______________________________________。
参考答案:(1)Na3N;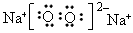
(2)N2O+CO2+H2O==2NaHCO3
(3)6Na+Fe2O3=3Na2O+2Fe;避免分解产生的金属钠可能产生的危害
(4)BD
(5)可溶性盐的成分可能是Na2CO3,或NaHCO3,或Na2CO3与NaHCO3的混合物。准确称取一定量的生成物,加热至恒重后,如试样无失重,则为Na2CO3;如加热后失重,根据失重的量在试样总质量中的比例,即可推断出试样为NaHCO3,或Na2CO3与NaHCO3的混合物。
本题解析:
本题难度:一般
5、实验题 (10分)丁烷的催化裂解可按下列两种方式进行:C4H10 →C2H6 + C2H4;C4H10 → CH4 + C3H6;化学兴趣小组的同学为探究丁烷裂解气中CH4和 C2H6的比例关系,设计实验装置如下图所示
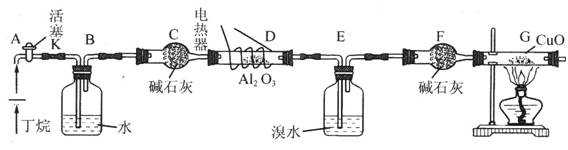 注:CuO能将烃氧化成CO2和H2O;后面的装置已略去。
注:CuO能将烃氧化成CO2和H2O;后面的装置已略去。
请回答下列问题:
(1)如图连接好装置后,需进行的实验操作有①给D、G装置加热;②检查整套装置的气密性;③排尽装置中的空气。这三步操作的先后顺序依次是?,
简要说明排空气和证明空气已排尽的方法?。
(2)为了调控实验过程中丁烷的气流速度,设置了B装置,操作时应观察?来实现实验的要求。
(3)若对E装置中的混合物再按以下流程实验:
 分离操作I和II的操作名称分别是:I?,II?。
分离操作I和II的操作名称分别是:I?,II?。
(4)假设丁烷完全裂解,且流经各装置中的气体均完全反应,为测定丁烷裂解产物中n(CH4):n(C2H6)的值,本实验中应该准确获取的数据应有?(选填下列数据序号)。
① C装置增加的质量?② E装置增加的质量?③ F装置增加的质量?④ G装置增加的质量
参考答案:(1)?(2)(3)(1)? 2分?打开活塞K通入丁烷气体排出装置中空气(1分),用一小试管收集从G装置右端导管口流出的气体,点燃检验其纯度(1分)
(2)气泡的逸出速度? 2分
(3)分液?蒸馏?每空2分
(4)(2)(3)(4) 2分,少选一个得1分,错选不得分
本题解析:略
本题难度:一般