1、选择题 “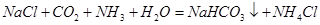 ”是“侯氏制碱法”的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是
”是“侯氏制碱法”的重要反应。下面是4位同学对该反应涉及的有关知识发表的部分见解。其中不正确的是
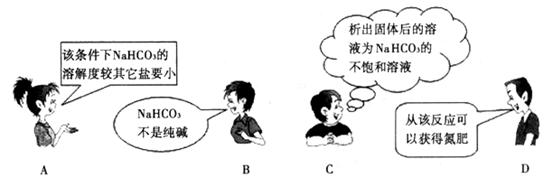
参考答案:C
本题解析:B 碳酸氢钠是纯碱又称小苏打。C析出固体后的溶液是饱和溶液。D 铵盐提供氮元素可以用作氮肥。
本题难度:一般
2、选择题 将一粒黄豆大小的金属钠,投入含饱和食盐水的烧杯中,下列实验现象不正确的(?)
A.反应后的水溶液可以使酚酞变红
B.钠跟食盐反应比与水反应更剧烈,并放出热量,发现嘶嘶声
C.钠熔成一个闪亮的小球,并在液面上向各方向迅速游动最后消失
D.食盐水出现浑浊现象
参考答案:B
本题解析:钠与盐溶液反应,先考虑Na与水反应生成NaOH,再考虑NaOH是否与盐反应。金属钠,投入含饱和食盐水的烧杯中,反应实质是2Na+2H2O===2NaOH+H2↑,不会比与水反应更剧烈,所以A、C选项正确,B选项不正确,因为减少了水的质量,因此析出NaCl晶体,可以看到食盐水出现浑浊现象,D选项正确。
本题难度:一般
3、选择题 锂也是碱金属元素,下列关于锂及其化合物的推断肯定正确的是(?)
A.锂单质可保存在煤油中
B.锂单质能与盐酸剧烈作用,并有气体产生
C.LiOH的碱性比NaOH的碱性强
D.Li+半径比Na+半径大
参考答案:B
本题解析:锂元素属于碱金属,其单质较活泼,能与H+作用产生H2,但因其原子序数较小,金属性比Na弱,离子半径也比钠离子小,且由于其密度比钠小,故不能保存在煤油中,B项正确。
本题难度:简单
4、选择题 将铷和另一碱金属组成的混合物4.6 g与水反应,生成了0.2 g氢气,则另一碱金属可能是(?)
A.锂
B.钠
C.铯
D.以上三种都有可能
参考答案:A
本题解析:假设4.6 g全部是铷,生成的氢气小于0.2 g,由此可知另一碱金属若为4.6 g,生成的氢气质量一定大于0.2 g,设另一碱金属的相对原子质量为Ar,则
2M+2H2O====2MOH+H2↑
2Ar? 2
4.6 g?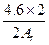 g>0.2 g
g>0.2 g
所以Ar<23,一定是锂。
本题难度:简单
5、选择题 下列物品盛放错误的是(? )
A.过氧化钾固体必须密封保存
B.烧碱必须密封保存
C.碱金属必须保存在煤油中
D.氢氧化钠溶液用带橡胶塞的玻璃瓶盛放
参考答案:C
本题解析:Li的密度比煤油小,不能用煤油保存,而应用石蜡密封保存。
本题难度:简单