1、选择题 对下列过程中发生反应的叙述正确的是
A.海水中含有钾元素,只需经过物理变化就可以得到钾单质
B.Na+、Mg2+、Al3+得电子能力很弱,故常用电解熔融氧化物的方法来制备其单质
C.从铝土矿中分离出氧化铝的过程中不涉及氧化还原反应
D.从海水中提取溴单质的过程所涉及的反应均为置换反应
参考答案:C
本题解析:A. 海水中的钾元素是钾离子,提取氯化钾固体,通过电解得到钾,发生了氧化还原反应,故A.错误; B.Na、Mg用电解熔融氯化物的方法来制备其单质。D海水提溴是先氧化溴离子为溴单质,再用还原剂(如SO2)还原溴单质为溴离子,再用氧化剂氧化溴离子为溴单质.此过程都是化学变化,但不均为置换反应。C铝土矿溶于NaOH溶液中发生Al2O3+2NaOH═2NaAlO2+H2O,没有元素的化合价变化,则不属于氧化还原反应,偏铝酸钠溶液的酸化发生AlO2-+H++H2O═Al(OH)3↓,没有元素的化合价变化,则不属于氧化还原反应,灼烧氢氧化铝固体发生2Al(OH)3 Al2O3+3H2O,没有元素的化合价变化,也不属于氧化还原反应,C正确。
Al2O3+3H2O,没有元素的化合价变化,也不属于氧化还原反应,C正确。
本题难度:一般
2、简答题 材料是人类赖以生存和发展的重要物质基础.
(1)普通玻璃的主要成分是______(填化学式)
(2)钢铁在潮湿空气中主要发生电化学腐蚀,炒过菜的铁锅未及时洗净(残液中含有氯化钠),第二天便出现红棕色的锈斑 (主要成分是Fe(OH)3失水后的产物).试用有关的电极反应式、化学方程式表示Fe(OH)3的生成.
①负极:______;
②正极:______;
③Fe(OH)3的生成:______、______.
参考答案:(1)普通玻璃的主要成分是二氧化硅、硅酸钠、硅酸钙,化学式为:SiO2、Na2SiO3、CaSiO3,
故答案为:SiO2、Na2SiO3、CaSiO3;
(2)①中性溶液中,钢铁中碳、铁和电解质溶液构成原电池发生吸氧腐蚀,负极上铁失电子生成二价铁离子,电极反应式为Fe-2e-=Fe2+,
故答案为:Fe-2e-=Fe2+;
②正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+4e-+2H2O=4OH-,
故答案为:O2+4e-+2H2O=4OH-;
③亚铁离子和氢氧根离子反应生成氢氧化亚铁氢氧化亚铁不稳定,容易被空气中的氧气氧化生成氢氧化铁4Fe(OH)2+O2+2H2O=4Fe(OH)3,最后,氢氧化铁失去部分水生成带结晶水 的氧化铁Fe2O3.xH2O,即铁锈的主要成分.
故答案为:Fe2++2OH-=Fe(OH)2↓;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
本题解析:
本题难度:简单
3、填空题 煤是重要的能源,也是化工生产的重要原料。
(1)煤燃烧产生的废气直接排放到空气中,可能导致的环境污染问题是_______。
(2)下图是对煤矿燃烧产生的废气进行常温脱硫处理的流程示意图。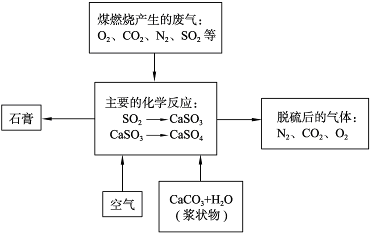
①废气脱硫过程中,主要反应的化学方程式为______________、_____________;
②在煤矿中直接添加一种物质,可有效减少煤矿燃烧产生的SO2,该物质是___;
③石膏的工业生产中的用途是_________________(写出一种用途即可)。
(3)煤经过___________(填加工方法)可以得到焦炉煤气、煤矿焦油和焦炭。煤焦油经过_______(填加工方法)可得到芳得族化合物。煤矿也可以用氢化法转化燃油,氢化法的本质是______________。
(4)煤可以液化转化为CH3OH,有人设计出在KOH溶液中用电极表面镀一层细小的铂粉做电极,铂吸附气体的能力强,性质稳定,利用CH3OH和O2构成的燃料电池的能量转化主要形式是 ?,负极反应式为 ?,电极表面镀铂粉的原因为? 。
参考答案:(1)酸雨、粉尘污染
(2)①SO2+CaCO3 CaSO3+CO2、2CaSO3+O2=2CaSO4
②CaCO3、CaO、Ca(OH)2
③医用、建筑材料、模型等合理答案
(3)干馏;分馏;增加煤中氢元素得含量,提高氢原子数与碳原子数的比值
(4)由化学能转化为电能;CH3OH+8OH- -6e-=CO32-+6H2O;增大电极单位面积吸附CH3OH、O2分子数,加速电极反应速率。
本题解析:(1)煤炭燃烧会产生二氧化硫,能产生酸雨,同时煤尘也对环境有污染作用。
(2)石灰石和空气进行脱硫工艺是,石灰石与二氧化硫反应生成亚硫酸钙和二氧化碳,亚硫酸钙继续氧化生成硫酸钙。①SO2+CaCO3 CaSO3+CO2、2CaSO3+O2=2CaSO4。二氧化硫是酸性氧化物,均与CaO、Ca(OH)2、CaCO3反应,产物均能生成石膏。②CaCO3或Ca(OH)2或CaO。③石膏可以用做医用、建筑材料、模型等。
(3)煤可以经过煤的干馏得到煤焦油、炉气和焦炭。煤焦油通过蒸馏得到芳香族化合物;煤中不含氢元素,可以通过加氢转化为燃油,其本质是增加煤中氢元素得含量,提高氢原子与碳原子数的比值。
(4)原电池的原理是化学能转化为电能。负极发生氧化反应,甲醇从负极通入,因而电极反应式是,CH3OH+8OH- -6e-=CO32-+6H2O。电极表面镀上一层铂粉,以增大电极单位面积吸附CH3OH、O2分子数,加速电极反应速率。
本题难度:简单
4、填空题 焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:

已知:反应Ⅱ包含2NaHSO3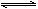 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式:?。
(2)“灼烧”时发生反应的化学方程式:?。
(3)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为:?。
(4)副产品X的化学式是:?;可循环利用的物质是:_________和_______。
(5)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为?。
参考答案:
(1)2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O?(2分)
2NH3↑+CaCl2+2H2O?(2分)
(2)2CuS+3O2 2CuO+2SO2?(2分)
2CuO+2SO2?(2分)
(3) S2O52-+2H+=2SO2↑+H2O?(2分)
(4) CuSO4?5H2O (2分)? CO2、H2O (各2分,共4分)?(5)2∶1?(2分)
本题解析:⑴实验室中制备氨气是用固体的氢氧化钙和固体的氯化铵来制备。(2)硫化铜灼烧一定生成氧化铜和二氧化硫。(3)根椐提示可知生成二氧化硫和水。(4)从生产过程可以看出是硫酸铜晶体;从图示中可以看出二氧化碳和水可以再次利用;反应Ⅱ中气体与固体分别是二氧化硫和碳酸钠,这两种物质反应必须生成亚硫酸氢钠:Na2CO3+2SO2=2NaHSO3+CO2;因此气体与固体的物质的量之比为:2∶1
本题难度:一般
5、选择题 下列物质中,作为燃料时对空气没有污染的是(? )
A.原油
B.氢气
C.汽油
D.煤
参考答案:B
本题解析:氢气燃烧产物为水,无污染。
本题难度:简单