1、实验题 某课外活动小组加热炭粉(过量)和氧化铜的混合物,再用下图装置,对获得的铜粉(含炭)样品进行实验。图中铁架台等装置已略去。请你帮助他们完成下列实验报告。
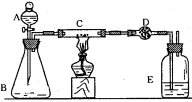
(1)实验目的:测定铜粉样品中铜的质量分数
(2)实验用品:仪器:天平、分液漏斗、锥形瓶、硬质玻璃管、干燥管、酒精灯、洗气瓶等,药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰、浓硫酸等。
(3)实验内容(见表1)表1?实验步骤、现象及化学方程式:
(4)计算:样品中铜的质量分数=______。(用含W、m1、m2的代数式表示。)
(5)问题和讨论:实验完成后,老师评议说:按上述实验设计,即使C中反应完全、D中吸收完全,也不会得出正确的结果。经讨论,有学生提出在B与C之间加入一个装置,再次实验后,得到了较正确的结果。那么,原来实验所测得的铜的质量分数偏小的原因可能是__________。在B与C之间加入的 装置可以是_____________,其中盛放的药品是____________。
装置可以是_____________,其中盛放的药品是____________。
参考答案:(3)
B、E中有气泡产生

C中的红褐色 粉末变成黑色
粉末变成黑色
2Cu+O2 2CuO
2CuO
C+O2 CO2
CO2
本题解析:略
本题难度:简单
2、选择题 下列各组物质中,X是主体物质,Y是其中含有的少量杂质,Z是为除去杂质而加入的试剂,其中能达到除杂目的组别是( )
| X | Y | Z
A
FeCl2溶液
FeCl3
KSCN溶液
B
CO2
HCl
饱和Na2CO3溶液
C
KCl溶液
MgCl2
适量NaOH溶液
D
FeCl2溶液
CuCl2
Fe粉
|
A.A
B.B
C.C
D.D
参考答案:A.加KSCN溶液可鉴别,不能除杂,则除杂氯化亚铁溶液中的氯化铁,应选择铁粉,故A错误;
B.二者均与碳酸钠溶液反应,不能除杂,则应选饱和碳酸氢钠溶液,故B错误;
C.引入新杂质钠离子,则应选择适量的KOH溶液除杂,故C错误;
D.Fe与氯化铜反应生成氯化亚铁和Cu,则利用Fe粉可除杂,不会引入新杂质,故D正确;
故选D.
本题解析:
本题难度:简单
3、填空题 某化学研究性学习小组为了探究四氯化锡的有关性质,拟先利用下列装置和药品进行四氯化锡的制备.已知四氯化锡具有强的吸水性,SnCl4和Sn的部分数据如下
| 密度 | 熔点 | 沸点
四氯化锡
2.2g?cm-3
-33℃
114℃
金属锡
5.77g?cm-3
231℃
|
供选择的药品:Sn、浓HC1、稀HCl、浓H2SO4、MnO2、KMnO4、无水CaCl2、碱石灰仪器装置:
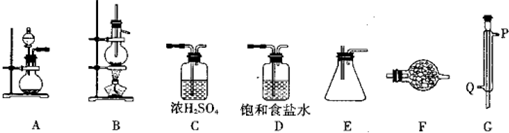
请回答下列相关问题:
(1)实验时装置的正确连接顺序为A→______→______→______→______→______→______;
(2)仪器G的名称是______;实验时,G中冷却水的流向是从______进入(填符号);
(3)A中发生反应的离子方程式为______;
(4)F中盛装的化学试剂是______;其作用是______;
(5)IVA族从上到下有C、Si、Ge、Sn、Pb等元素,请比较该族元素最高价氧化物对应水化物碱性的强弱顺序为(用化学式表示)______.
参考答案:(1)用A制备氯气,分别在D、C中进行除杂和干燥,然后在B中发生反应制备SnCl4,冷却后在E中收集,最后连接F,进行尾气吸收,连接顺序为D→C→B→G→E→F,
故答案为:D→C→B→G→E→F;
(2)G为冷凝管,为达到充分冷凝的效果,应从Q进水,从P出水,故答案为:冷凝管;Q;
(3)A中制备氯气,在不加热的条件下进行,应用高锰酸钾和浓盐酸制备,反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,
故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(4)F中盛装碱石灰,具有碱性,可与水或酸性气体反应,防止空气中的水分进入装置E中,吸收多余的Cl2防止污染,
故答案为:碱石灰;防止空气中的水分进入装置E中,吸收多余的Cl2防止污染;
(5)金属性:Pb>Sn>Ge,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则Pb(OH)4>Sn(OH)4>Ge(OH)4,
故答案为:Pb(OH)4>Sn(OH)4>Ge(OH)4.
本题解析:
本题难度:一般
4、实验题 某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。
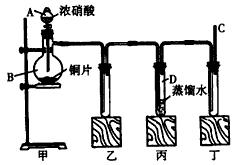
请回答下列问题:
(1)装置甲中盛放浓硝酸的仪器A的名称是___________,该装置中发生反应的化学方程式为______________________。
(2)实验过程中,装置乙、丙中出现的现象分别是_________、___________,装置丙中的试管内发生反应的离子方程式为_____________________。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是______。
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为________色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加KSCN溶液,溶液变为___________色。
参考答案:(1)分液漏斗;Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(2)生成红棕色气体;生成无色气体、蒸馏水中有气泡;3NO2+H2O=2H++2NO3-+NO
(3)氧气
(4)黄;红(或“血红”)
本题解析:
本题难度:一般
5、选择题 下列有关实验操作的叙述正确的是
A.配制FeCl3溶液时,将FeCl3溶解在较浓的盐酸中,再用水稀释到所需浓度
B.进行焰色反应时,所用铂丝先用NaOH溶液洗涤并充分灼烧
C.用CCl4萃取碘水中的I2时,有机层从分液漏斗的上端倒出
D.酸碱中和滴定时,锥形瓶需用待测液润洗2次,再加入待测液
参考答案:A
本题解析:氯化铁是能够水解的强酸弱碱盐,即FeCl3+3H2O Fe(OH)3+3HCl,用水溶解或稀释能促进铁离子水解,用盐酸溶解能抑制铁离子水解,故A选项正确;氢氧化钠溶液含有钠元素,引入钠元素导致火焰呈黄色,对实验结果造成干扰,因此不能用氢氧化钠溶液洗涤,应选稀盐酸洗涤铂丝,故B选项错误;四氯化碳的密度大于水,萃取之后有机层位于分液漏斗的下层,因此有机层先从分液漏斗的下端放出,然后水层从分液漏斗的上端倒出,故C选项错误;锥形瓶只需要用蒸馏水洗涤,如果用待测液润洗,则滴定时消耗标准溶液的体积偏大,导致测定结果偏高,只有酸式或碱式滴定管才能用待装液润洗,故D选项错误。
Fe(OH)3+3HCl,用水溶解或稀释能促进铁离子水解,用盐酸溶解能抑制铁离子水解,故A选项正确;氢氧化钠溶液含有钠元素,引入钠元素导致火焰呈黄色,对实验结果造成干扰,因此不能用氢氧化钠溶液洗涤,应选稀盐酸洗涤铂丝,故B选项错误;四氯化碳的密度大于水,萃取之后有机层位于分液漏斗的下层,因此有机层先从分液漏斗的下端放出,然后水层从分液漏斗的上端倒出,故C选项错误;锥形瓶只需要用蒸馏水洗涤,如果用待测液润洗,则滴定时消耗标准溶液的体积偏大,导致测定结果偏高,只有酸式或碱式滴定管才能用待装液润洗,故D选项错误。
本题难度:简单