浓氨水呈碱性
参考答案:D
本题解析:A不正确,还可能含有银离子。B不正确,也可能含有H CO3-。C不正确,也可能是氯气,所以正确的答案选D。
本题难度:一般
3、选择题 采用下列装置和操作,能达到实验目的的是
 ? ? ? ? ? ?
甲?乙?丙?丁
A.甲装置:加热浓硫酸和乙醇(其体积为比3∶1)混合液,制取乙烯
B.乙装置:比较醋酸、碳酸、苯酚三者的酸性强弱
C.丙装置:向混有苯酚的苯中加入NaOH溶液,除去其中的苯酚
D.丁装置:A中为乙醇、醋酸,B为饱和碳酸钠溶液,制取乙酸乙酯
参考答案:BC
本题解析:A、实验室制取乙烯时需要控制溶液的温度为170℃,水银球应该放在溶液中,A不正确;B、醋酸与碳酸钙反应生成CO2,通入饱和的碳酸氢钠溶液中除去挥发出的乙酸,然后通入到苯酚钠溶液中生成苯酚,因此乙装置:比较醋酸、碳酸、苯酚三者的酸性强弱,B制取;C、苯酚能与氢氧化钠溶液反应,苯与氢氧化钠溶液反应,因此丙装置:向混有苯酚的苯中加入NaOH溶液,除去其中的苯酚,C制取;D、制取乙酸乙酯时需要浓硫酸作催化剂和吸水剂,D不正确,答案选BC。
本题难度:一般
4、实验题 亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及生成气体产物的成分。已知:
①NO+NO2+2OH-=2NO2-+2H2O
②气体液化的温度:NO2? 21℃、NO?-152℃
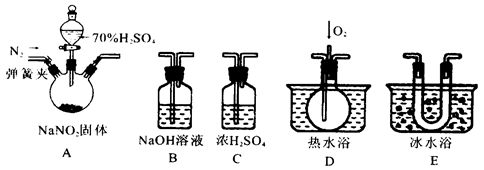
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→C→_______→_______→_______;组装好仪器后,接下来进行的操作是________________。
(2)关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后, A中产生红棕色气体.
①确认A中产生气体含有NO,依据的现象是_____________________________.
②装置E的作用是_______________________________________________________
(3)如果向D中通入过量O2,则装置B中发生反应的化学方程式为________________.
如果没有装置C,对实验结论造成的影响是______________________________。
(4)通过上述实验探究过程,可得出装置A中反应的化学方程式是_______________。
(5)工业生产中氮氧化物的排放会造成环境污染,可采用如下方法处理氮氧化物:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)?△H=-867kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)?△H=-1160kJ·mol-1
则CH4将NO2还原为NO的热化学方程式为:___________________________.
参考答案:
(1)E D B(2分);检验装置的气密性(1分)? (2)①D中出现红棕色气体(2分)? ②冷凝,使NO2完全液(2分)(3)4NO2+O2+4NaOH=4NaNO3+2H2O(2分)?水会与NO2反应产生NO,影响NO的确定(2 分)
(4)2NaNO2+H2SO4=Na2SO4+NO2↑+NO↑+H2O(2分)
(5) CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)?△H=-574kJ·mol-1(2分)
本题解析:本题是实验题。实验题是同学们的难点。也是最难得分的题型。对于实验题,首先需看清楚实验目的是什么。在结合看清实验流程,实验操作,物质检验等知识会穿插其中。这题是一道实验探究题,探究NaNO2与H2SO4的反应。从所给装置中,A显然是发生装置。B是NaOH溶液,可能是除杂装置,C是浓硫酸,显然是干燥装置。D是热水浴,并通入了O2,需要通O2检验的是NO气体。E是冷水浴装置。显然是冷却物质。由题中所给2个信息,第一个信息是NO与NO2的混合气体与NaOH发生归中反应。第二个信息是NO、NO2两种气体的物理性质。从液化的温度来看,显然NO2比NO更易液化。A中三颈瓶,采用固液不加热反应,还有一个弹簧夹用来控制通氮气,显然要氮气,目的应是排除氧气。因氧气有氧化性。可能会对实验结果产生干扰。通过上述信息就可以猜测出产生的两种气体可能是NO和NO2。
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):
A是发生装置,C是干燥除去水,NO和NO2的分离,先分离NO2因为更易液化。所以接E,NO2分离后再检验NO,需通氧气。接D。观察到气体从无色变成红棕色。所以说明是NO。B是尾气处理。吸收反应后剩余的NO和NO2的混合气体。在这里存在几个先后问题,首先NO和NO2的检验,根据液化温度判断得到NO2更易液化,可以观察到E中有红棕色液体产生。而后NO会和氧气生成NO2。对于NO2的检验会产生干扰。所以先检验NO2。还有一问题就是除水,如果不除去水的话,NO2会与H2O反应生成NO,所以又会对NO的检验产生干扰,同时也影响NO2的检验。还有一问题就是在A中药品反应之前需通氮气将O2排出来。否则也会影响NO和NO2的检验。装置连接好之后,就是检查装置气密性。
(2)关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后, A中产生红棕色气体。说明生成了NO2气体。
①确认A中产生气体含有NO,是在D装置中通O2来检验的。观察气体是否变红棕色。
②装置E的作用是冷凝,是使NO2完全液化。
(3)如果向D中通入过量O2,不存在NO剩余,但有过量的O2会与NO2发生氧化还原反应,O2降低,NO2升高,所以可推断出反应方程式为:4NO2+O2+4NaOH=4NaNO3+2H2O。如不干燥,水会与NO2反应产生NO,影响NO的确定。
(4)通过上述实验探究过程,可得出装置A中反应应产生两种气体。+3价氮元素发生歧化反应。化学方程式是2NaNO2+H2SO4=Na2SO4+NO2↑+NO↑+H2O。
(5)工业生产中氮氧化物的排放会造成环境污染,可采用如下方法处理氮氧化物:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)?△H=-867kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)?△H=-1160kJ·mol-1
根据盖斯定律上式×2-下式可得出:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)?△H=-574kJ·mol-1(2分)
本题难度:一般
5、填空题 类比是化学学习中常用的方法之一,已知硝酸能把铁氧化成 Fe ( NO3)3、,但当铁过量时,产物是 Fe ( NO3 ) 2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 C12足量时生成 FeC13 , 当铁粉过量时产物是 FeCl2。为验证该观点是否正确,该同学将一根细的纯铁丝分别在足量和少量的 C12中点燃,取其表面生成物并分别编号为 A、B ,然后通过实验确定其成分。探究过程如下:
( 1 )提出假设: A 是 FeCl3, B 是 FeCl 2。
( 2 )设计实验方案:分别取 A、B 的溶液均进行以下实验,但实验现象相同。请填写下表中的相应空格。

( 3 )根据上述实验结论,写出 C12与铁粉加热时发生反应的化学方程式:
_________________________________________________________________。
( 4 )为进一步探究 FeC13溶液的性质,他又利用 A 溶液做了如下一些实验,其中明显错误的是____________________。
A.将 A 溶液滴入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔现象
B.向 A 溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在 A 溶液中滴加 Na OH 浓溶液,出现红褐色沉淀
D.将 A 溶液加热蒸干并灼烧,得到 FeC13固体
( 5 )实际应用:
FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有 FeC13、FeCl2、CuCl2,某研究性学习小组的同学们设计了两种从废液中回收 Cu的方案:
方案1:向废液中加人过量的铁粉,充分反应后,过滤。在所得滤渣中加人足量的盐酸,充分反后,再过滤即得到铜。方案1 中涉及的四种阳离子的氧化性由强到弱的顺序为:
_____________________________________。
方案2 :在废液中加人适量的盐酸调节溶液的 pH =" 1" ,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的 Cu 已全部析出。方案 2 中铜作_________极,所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)___________________________________________________
方案 2 在电极上直接回收铜,操作上比方案 1 简便,但方案 2 也有不足之处,主要表现为:_____________________________________________________。
参考答案:(2)溶液变红色(1分) FeCl2 ( 1 分) ( 3 ) 2Fe十3Cl2 2FeCl3 ( l 分) 2FeCl3 ( l 分)
( 4 ) BD (2分) ( 5 )方案 1 : Fe3+ >Cu2+ > H + > Fe2+ ( l 分)
方案 2 :阴( l 分)2Fe 3++2e一=2Fe2+ ;
Cu2+ + 2e一=Cu ( l 分);
2H + + 2e一=H2↑; ( l 分)
①污染性气体 C12产生( l 分)②使用了电解装置,成本较高等。( l 分)
本题解析:Fe3+遇SCN一变红色。 Fe2+能使 KMnO4溶液褪色; FeC13溶液加人铁粉,将三价铁还原为二价铁,颜色变浅; FeC13溶液加热蒸干最后得到的是三氧化二铁, ( 5 )向废液中加人过量的铁粉,铁粉首先和三价铁离子反应,将其转化为二价铁离子,然后和铜离子反应,再加人盐酸,盐酸和过量的铁粉反应生成二价铁离子,由此知四种离子的氧化性由强到弱的顺序为Fe3+ >Cu2+ > H+ >Fe2+,方案 2 中用铜作阴极,电极上的反应为2Fe3++2e一=2Fe2+,然后 Cu2++2e一=Cu , 2H+十2e一=H 2↑ , 不足之处,阳极会产生氯气污染,会消耗大量的电能等。
本题难度:一般
|