1、选择题 为提纯下列物质(括号中为杂质),所选除杂试剂和分离方法都正确的是(? )
选项
| 被提纯的物质(杂质)
| 除杂试剂
| 分离方法
|
A
| NH3(H2O)
| 浓硫酸
| 洗气
|
B
| H2O(Br2)
| CCl4
| 分液
|
C
| KCl固体(I2)
| KOH溶液
| 加热
|
D
| MgCl2溶液(FeCl3)
| NaOH溶液
| 过滤
|
?
参考答案:B
本题解析:浓硫酸能吸收氨气,A错误;C选项中反应后的溶液互溶,加热无法分离,应该把固体混合物直接加热,使碘升华;D选项,MgCl2溶液中加NaOH,一方面会引入Na+,另一方面,Mg2+也能形成沉淀
本题难度:一般
2、实验题 为了将混有硫酸钠、碳酸氢铵的氯化钠提纯,并制得纯净的氯化钠溶液,某学生设计如下实验:
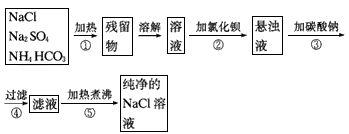
(1)操作②能否用硝酸钡溶液?____。理由是____。
(2)进行操作②后,如何判断SO42-已除尽,方法是____。
(3)操作③的目的是_____;为什么不先过滤而后加碳酸钠溶液,其理由是____。
(4)此设计方案是否严密,如不严密,说明如何改进_____________。
参考答案:(1)不能 ;会引入新的杂质(NO3-)
(2)取少量上层澄清溶液,滴加BaCl2溶液,如无沉淀出现则说明SO42-已除尽,反之则有
(3)除去过量的Ba2+一次性过滤,简化实验步骤
(4)不够严密。a.在②、③处加过量溶液;b.在⑤处应先加过量的盐酸(除去过量的CO32-)后再加热。
本题解析:
本题难度:一般
3、填空题 (12分).目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:

请回答下列问题:
(1)从离子反应的角度思考,写出在沉淀池的离子方程式??。
(2)操作A是?,操作B是??。
(3)加入的足量试剂a是??(填化学式)。
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为??。
(5)有同学认为:可直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你? (填“同意”或“不同意”)此观点。
参考答案:Mg2+ + 2OH- ="=" Mg(OH)2↓?过滤?加热浓缩(或蒸发结晶)? HCl?
MgCl2(熔融)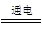 ?Mg + Cl2↑?不同意
?Mg + Cl2↑?不同意
本题解析:(1)镁离子和OH-结合生成氢氧化镁沉淀,离子方程式为Mg2+ + 2OH- ="=" Mg(OH)2↓ 。
(2)氢氧化镁不溶于水,过滤即可。氯化镁易溶于水,要得到氯化镁晶体,需要加热浓缩(或蒸发结晶)。
(3)氢氧化镁和盐酸反应才能生成氯化镁,即a是氯化氢。
(4)镁是活泼的金属,需要通过电解法冶炼,方程式为MgCl2(熔融)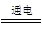 ?Mg + Cl2↑。
?Mg + Cl2↑。
(5)氧化镁的熔点太高,熔合要消耗大量的能量,所以此观点是错误的,不同意。
本题难度:一般
4、选择题 下列关于蒸馏操作要点及原因中,正确的是( ? )
A.蒸馏烧瓶可以直接加热,不用垫石棉网
B.温度计水银球插入蒸馏的混合液中,以控制蒸馏的温度
C.冷凝管中冷却水与被冷凝蒸气或液体流向相反,增强冷凝效果
D.烧瓶内放些碎瓷片以免爆炸
参考答案:C
本题解析:
本题难度:一般
5、选择题 下列所用除杂的试剂和操作方法均正确的是
A.②④
B.①④
C.②③
D.①③
参考答案:A
本题解析:试题分析:乙烯中含有碳碳双键,也能和氯水发生加成反应,①不正确,应该用氢氧化钠溶液;乙酸乙酯不溶于饱和碳酸钠溶液中,而乙酸可以溶解在饱和碳酸钠溶液中,所以②正确;苯酚虽然能和溴水反应,但生成的白色沉淀又可以溶解在苯中,③不正确,应该用氢氧化钠溶液;乙醇和水互溶,所以应该用新制的生石灰,蒸馏,④正确,答案选A。
考点:考查物质的分离和提纯
点评:该题是高考中的重要考点之一,也是高考中的常见题型,属于中等难度的试题。该题需要明确的是在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
本题难度:简单