| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《化学平衡》高频试题强化练习(2020年最新版)(十)
参考答案: 本题解析::(1)根据题给化学方程式结合平衡常数表达式的书写原则写出上述反应的平衡常数表达式为:c4(H2O)/c4(H2);(2)①根据题给图像分析,与曲线a比较,曲线b缩短了达平衡的时间,氢气的平衡浓度未发生变化,则曲线b改变的条件为使用催化剂;②与曲线a比较,曲线c缩短了达平衡的时间,氢气的平衡浓度减小,则曲线c改变的条件为升高温度; 温度升高,达平衡时间缩短,平衡时H2浓度减少,说明升高温度平衡向正反应方向移动。该反应的△H>0;(3)①该温度下,向2L盛有1.42g Na2SO4的密闭容器中通入H2,5min后测得固体质量为1.10g,固体质量减少0.32g,利用差量法计算,则该时间范围内参加反应氢气的物质的量0.02mol,根据v=△n/V△t计算,则该时间范围内的平均反应速率v(H2)=0.002mol/(L.min);②A、该反应为反应前后气体物质的量不变的反应,容器内压强不随反应的进行而变化,不能作为平衡标志,错误;B、容器内气体密度随反应的进行而变化,密度不变已达平衡,正确;C、达平衡后c(H2)和c(H2O)不一定相等,错误;D、v正(H2)=v逆(H2O),说明反应已达平衡,正确;答案选B、D。 本题难度:一般 4、填空题 (10分)已知A(g)+B(g)
(1).该反应的平衡常数表达式K= 。 (2).830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。,则6s时c(A)= mol·L-1,若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为 ; (3).1200℃时反应C(g)+D(g) 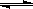 A(g)+B(g)的平衡常数的值为 。 A(g)+B(g)的平衡常数的值为 。 参考答案:(1) 本题解析:试题分析:(1)该反应平衡常数表达式为 本题难度:困难 5、选择题 在一定条件下,密闭容器中发生可逆反应2X(g)+2Y(g) |
参考答案:D
本题解析:可逆反应中,反应物不可能在反应中完全转化,由于反应中X、Y按照物质的量2:1反应,所以X过量0.5mol,生成3molZ,2molW,但反应不可能完全进行到底,所以0.5mol/L<C(X)<2.5mol/L;0<C(Z)<3mol/L;0<C(W)<2mol/L.故D一定错误,答案选D.
考点:化学反应的可逆性
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《物质的分类.. | |