| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《离子方程式的书写及正误判断》试题特训(2020年最新版)(二)
参考答案: 本题解析: 本题难度:一般 2、填空题 (14分)Na、Cu、O、Si、S、Cl是常见的六种元素。
(4)ClO2常用子水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目_________________。 参考答案:(1)3 ⅠA 2 1s22s22p63s23p2 本题解析: 本题难度:一般 3、选择题 化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是 |
参考答案:B
本题解析:A、氢氧燃料电池中的负极发生氧化反应,所以氢气失去电子,因为电解质为碱性,所以氢气失去电子与氢氧根离子结合生成水,错误;B、电解饱和食盐水时,阳极时氯离子放电生成氯气,正确;C、精炼粗铜时,粗铜应该失去电子进入溶液,所以粗铜做阳极,纯铜作阴极,与电源正极相连的是粗铜,错误;D、钢铁发生电化学腐蚀时,正极发生还原反应,所以时氧气得到电子生成氢氧根离子,错误,答案选B。
考点:考查电化学反应原理的应用,电极反应式书写的判断
本题难度:一般
4、选择题 下列离子方程式书写正确的是
A.以石墨为电极电解MgCl2溶液:2Cl—+2H2O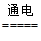 Cl2+H2↑+2OH—
Cl2+H2↑+2OH—
B.强碱溶液中NaClO与Fe(OH)3反应:3ClO—+2Fe(OH)3=2FeO42—+3Cl—+H2O+4H+
C.Na2CO3溶液与少量AlCl3溶液反应:3CO32-+Al3++3H2O=3HCO3-+Al(OH)3↓
D.用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2OH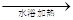 CH3COO-+NH4++3NH3+2Ag↓+H2O
CH3COO-+NH4++3NH3+2Ag↓+H2O
参考答案:C
本题解析:A.以石墨为电极电解Cl2溶液:MgCl2+2H2O Mg(OH)2↓+H2↑+Cl2↑,故A错误。B.强碱溶液中NaClO与Fe(OH)3反应:3ClO—+2Fe(OH)3+4OH-=2FeO42—+3Cl—+5H2O,故B错误。C.Na2CO3溶液与少量AlCl3溶液反应放不出CO2生成HCO3-:3CO32-+Al3++3H2O=3HCO3-+Al(OH)3↓,故C正确。D.用银氨溶液检验乙醛中的醛基:
Mg(OH)2↓+H2↑+Cl2↑,故A错误。B.强碱溶液中NaClO与Fe(OH)3反应:3ClO—+2Fe(OH)3+4OH-=2FeO42—+3Cl—+5H2O,故B错误。C.Na2CO3溶液与少量AlCl3溶液反应放不出CO2生成HCO3-:3CO32-+Al3++3H2O=3HCO3-+Al(OH)3↓,故C正确。D.用银氨溶液检验乙醛中的醛基:
CH3CHO+2[Ag(NH3)2]++2OH-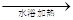 CH3COO-+NH4++3NH3+2Ag↓+H2O,故D错误。
CH3COO-+NH4++3NH3+2Ag↓+H2O,故D错误。
考点:了解离子反应的概念、离子反应方程式的书写。
点评:离子方程式正误判断要在掌握基本方法的基础上,针对反应中物质的性质、反应的条件、反应的环境等因素具体分析,正确判断。
本题难度:困难
5、填空题 有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去也不易得到电子,其基态原子中每种能级电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3:1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大。
(1)E元素在周期表中的位置 ;E元素价电子排布式为 。
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是 (写分子式)。
(3)B与D形成的非极性分子的电子式为________。
(4)B、C、D三种元素的第一电离能由大到小的顺序是____________(用元素符号表示)。
(5)C的单质分子中σ键和π键的个数比为________。
(6)已知在25℃、101kPa下:ABC(aq)+A2D(1)BC-(aq)+A3D+(aq) ΔH=+45.6kJ·mol-1
A3D+(aq)+DA-(aq)=2A2D(1)ΔH=-57.3kJ·mol-1
则在25℃、101kPa的稀溶液中,ABC与DA-反应的热化学方程式是(以离子方程式表示): 。
参考答案:(1)第4周期VIII族(2分);3d64s2(2分);(2)H2O、NH3、CH4(2分);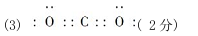 ;(4)N>O>C(2分);(5)1:2(2分);(6)HCN(aq)+OH-(aq)=CN-(aq)+H2O(1分) ΔH=-11.7kJ·mol-1(3分)
;(4)N>O>C(2分);(5)1:2(2分);(6)HCN(aq)+OH-(aq)=CN-(aq)+H2O(1分) ΔH=-11.7kJ·mol-1(3分)
本题解析:短周期中族序数等于周期数的非金属元素只有H,故A为H;由B元素原子的得失电子能力可判断B为C,其1s、2s、2p轨道各有2个电子;C元素的价电子构型为nsnnpn+1,由s轨道容纳2个电子可知n只能等于2,故C为N;由最外层电子数与电子层数的关系可知D为O;由E在地壳中含量可知其为Fe
考点:元素化合物知识;元素周期表;化学基本理论;热化学方程式及其计算
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《气体的净化.. | |