1、选择题 下列各元素原子排列中,其电负性减小顺序正确的是( )
A.K>Na>Li
B.F>O>S
C.P>Mg>Al
D.C>N>O
参考答案:B
本题解析:非金属性越强,电负性越大,所以选项B正确。其余都是错误的,答案选B。
本题难度:一般
2、选择题 X、Y、Z、3种元素的离子具有相同的电子层结构,离子半径X>Y,Y与Z可形成ZY2型离子化合物,则3种元素的原子序数关系是(? )
A.X>Y>Z
B.Y>X>Z
C.Z>X>Y
D.Z>Y>X
参考答案:D
本题解析:由ZY2型离子化合物知Z为+2价,Y为-1价,所以在两者在周期表中的位置是
?
?
?
?
?
X
?
Y
?
?
?Z
?
?
?
?
?
又离子半径X>Y,结合 X、Y元素的离子具有相同的电子层结构,所以Y离子也应该是与Y同周期的位于Y前面的非金属元素,它们的相对位置如上所示,那么原子序数则是Z>Y>X,D项正确。
本题难度:一般
3、选择题 下列递变规律正确的是
A.O、S、Na、K的原子半径依次增大
B.Na、Mg、Al、Si的金属性逐渐增强
C.钾离子氧化性比钠离子强
D.Mg(OH)2、Al(OH)3、KOH、Ca(OH)2碱性逐渐增强
参考答案:A
本题解析:同周期自左向右,原子半径逐渐减小,同主族自上而下原子半径逐渐增大,A正确;同周期自左向右金属性逐渐减弱,同主族自上而下金属性逐渐增强,则选项B不正确,Na、Mg、Al、Si的金属性逐渐减弱;金属性越强,相应金属阳离子的氧化性越弱,C不正确,钾离子氧化性比钠离子弱;金属性越强,最高价氧化物的水化物的碱性越强,D不正确,Al(OH)3、Mg(OH)2、Ca(OH)2、KOH碱性逐渐增强,答案选A。
点评:该题主要是考查学生对元素周期律的熟悉了解程度,以及灵活运用元素周期律解决实际问题的能力。难度不大。该题的关键是熟练记住元素周期律的具体内容,然后结合题意灵活运用即可,有利于培养学生的逻辑思维能力。
本题难度:简单
4、填空题 (12分)A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素。
请用化学用语回答:
(1)推断B元素在元素周期表中的位置?,写出C的单质的电子式?。
(2)A与D形成的18电子的化合物与FD2化合生成一种强酸,其化学方程式为?。
(3)E、F、G三种元素所形成的简单离子,其离子半径由大到小的顺序是?。(用离子符号表示)
(4)用电子式表示化合物E2F的形成过程?。
(5)下图为某新型发电装置示意图,其负极电极反应为?。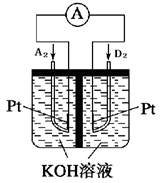
参考答案:(1)第二周期?ⅣA族(2分)? ?(2分)
?(2分)
(2) H2O2+SO2=H2SO4(2分)?(3) S2->Cl->Na+(2分)?
(4)略(2分)?
(5) H2-2e-+2OH-=2H2O(2分)
本题解析:“A元素原子核内无中子”,则A为11H;B元素的核外电子排布为2 4,则B为碳元素;“D是地壳中含量最多的元素”,则D为氧元素、C为氮元素;“E是短周期中金属性最强的元素”,则E为钠元素;“F与G位置相邻,G是同周期元素中原子半径最小的元素”,则G为氯元素、F为硫元素;
(1)电子层数=周期序数,最外层电子数=主族序数;
(2)H2O2(表现氧化性)与SO2(表现还原性)发生氧化还原反应;
(3)具有相同核外电子排布的离子,原子序数越大,离子半径越小,故S2->Cl-;
再S2-、Cl-核外有三层电子,Na+核外有两层电子,故S2->Cl->Na+;
(4)每个钠原子失去最外层的1个电子;硫原子得两个电子,使最外层达8电子稳定结构;
Na2S的电子式为:
(5)构成碱性条件下的氢氧原电池,故(-):H2-2e-+2OH-=2H2O;
本题难度:一般
5、选择题 下列各组顺序的排列不正确的是
A.离子半径:Na+>Mg2+>Al3+>F—
B.热稳定性:HCl>H2S>PH3
C.酸性强弱:Al(OH)3<H2SiO3<H2CO3<H3PO4
D.熔点:SiO2>NaCl>Na>CO2
参考答案:A
本题解析:A、离子的核外电子层数越多离子半径越大,核外电子排布相同的微粒其微粒半径随原子序数的增大而减小,则离子半径:F—>Na+>Mg2+>Al3+,A不正确;B、非金属性是Cl>S>P,非金属性越强氢化物的稳定性越强,所以热稳定性:HCl>H2S>PH3,B正确;C、非金属性越强最高价氧化物对应水化物的酸性越强,非金属性是Al<Si<C<P,则酸性强弱:Al(OH)3<H2SiO3<H2CO3<H3PO4,C正确;D、二氧化硅是原子晶体,氯化钠是离子晶体,金属钠是金属晶体,二氧化碳是分子晶体,所以熔点:SiO2>NaCl>Na>CO2,D正确,答案选A。
本题难度:一般