1、选择题 下列说法正确的是( )
A.可用加热的方法除去混在碳酸钠固体中的碳酸氢钠固体
B.除去CO中少量的O2,可将混合气体通过灼热的Cu网
C.向某溶液中加入盐酸产生使澄清石灰水变浑浊的气体,该气体可能是CO2,也可能不是
D.向某溶液中加入盐酸酸化的BaCl2溶液有白色沉淀,该溶液中一定含有SO42-
参考答案:A.碳酸氢钠受热分解,碳酸钠受热不分解,可用加热的方法除去混在碳酸钠固体中的碳酸氢钠固体,故A正确;
B.除去CO中少量的O2,混合气体通过灼热的Cu网,氧气和铜反应生成氧化铜会和一氧化碳反应,故B错误;
C.向某溶液中加入盐酸,产生使澄清石灰水变浑浊的气体可能是二氧化碳或二氧化硫,故C正确;
D.向某溶液中加入盐酸酸化的BaCl2溶液有白色沉淀,该溶液中可能含有硫酸根离子或银离子,故D错误.
故选AC.
本题解析:
本题难度:简单
2、实验题 某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃。微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图。
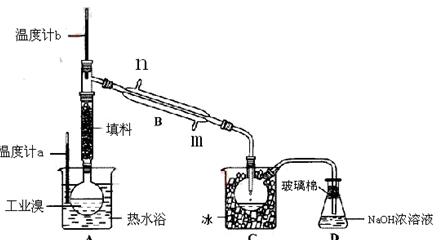
请你参与分 析讨论:
析讨论:
①图中仪器B的名称: ,冷却水从?进,?出;
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是 。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件: 。
④C中液体产生颜色为 ;
⑤烧杯A的作用?, D中液体的作用是?。
参考答案:
本题解析:略
本题难度:一般
3、选择题 下列操作不能达到目的是( )
| 选项 | 目的 | 操作
A.
配制100 mL 1.0 mol/L CuSO4溶液
将25 g CuSO4?5H20溶于100 mL蒸馏水中
B.
除去KNO3中少量NaCl
将混合物制成热的饱和溶液,冷却结晶,过滤
C.
在溶液中将MnO4-完全转化为Mn2+
向酸性KMnO4溶液中滴加H2O2溶液至紫色消失
D.
确定NaCl溶液中是否混有Na2CO3
取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊
|
A.A
B.B
C.C
D.D
参考答案:A.25 g CuSO4?5H2O的物质的量为0.1mol,溶于水配成0.1L的溶液,所得溶液的浓度为1mol/L,溶液的体积为100mL,不是溶剂的体积为100mL,故A错误;
B.硝酸钾溶解度受温度影响很大,氯化钠溶解度受温度影响不大,将混合物制成热的饱和溶液,冷却结晶,硝酸钾析出,过滤,可以除去KNO3中少量NaCl,故B正确;
C.KMnO4具有强氧化性,可以氧化H2O2溶液,自身被还原为Mn2+,紫色褪去,说明KMnO4完全反应,故C正确;
D.氯化钠中若含有碳酸钠,溶液中滴加氯化钙会生成碳酸钙白色沉淀,若没有碳酸钠,则没有白色沉淀产生,故D正确;
故选A.
本题解析:
本题难度:简单
4、实验题 下图表示从固体混合物中分离X的2种方案,请回答有关问题。

(1)选用方案I时,X应该具有的性质是____________,残留物应该具有的性质是_______________;
(2)选用方案Ⅱ从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是___________,有关反应的化学方程式为__________________;
(3)为提纯某Fe2O3样品(主要杂质有SiO2、Al2O3),参照方案I和Ⅱ,请设计一种以框图形式表示的实验方案(注明物质和操作)______________________________________。
参考答案:(1)有挥发性(或易升华);受热不挥发,且具有较高的热稳定性
(2)HNO3;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O、3Ag+4HNO3(稀)=3AgNO3+NO↑+2H2O [或Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、Ag+2HNO3(浓)=AgNO3+NO2↑+2H2O](3)“略”
本题解析:
本题难度:一般
5、选择题 0.1 mol/LNa2SO4溶液300 mL、0.1 mol/LMgSO4溶液200 mL和0.1 mol/LAl2(SO4)3溶液100 mL,这三种溶液中硫酸根离子浓度之比是
A.1∶1∶1
B.3∶2∶1
C.3∶2∶3
D.1∶1∶3
参考答案:D
本题解析:
本题难度:一般