| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《物质的量》高频考点巩固(2020年模拟版)(十)
参考答案: 本题解析: 本题难度:困难 3、填空题 欲用98%的浓硫酸(p=1.84g·cm-3 )配制成浓度为0.5mol·L-1的稀硫酸500ml。 |
参考答案:(1)量筒 烧杯 玻璃棒 容量瓶(500ml) 胶头滴管 (2)AEFDCB (3)13.6 15
(4)玻璃棒 保证溶质完全转移 (5)偏低 偏高 偏低 不影响
本题解析:
试题解析:(1)操作步骤有计算、量取、稀释、洗涤、定容、摇匀等操作,一般用量筒量取浓硫酸,在烧杯中稀释(可用量筒量取水加入烧杯),并用玻璃棒搅拌.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管.故答案为:量筒;烧杯;玻璃棒;500mL容量瓶;胶头滴管;(2)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知正确的操作顺序是:AEFDCB;
(3)浓硫酸的物质的量浓度为c=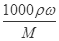 =
=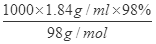 =18.4mol/L,设需要的浓硫酸额体积为Vml,根据溶液稀释定律C浓V浓=C稀V稀可知:18.4mol/L×Vml=0.5mol?L-1×500mL,解得V=13.6mL,根据“大而近”的原则,根据需要量取的浓硫酸的体积为13.6mL可知选用15mL量筒,故答案为:13.6;15;(4)在转移时应使用玻璃棒引流,需要洗涤烧杯2~3次是为了保证溶质完全转移;(5)①某学生观察定容时仰视液面,则加水的量偏多了,所配溶液的浓度会偏低,②未经冷却就直接定容配置将使浓度,待冷却后溶液体积偏小,则浓度偏高;③摇匀后发现液面低于刻度线再加水,则加水的量偏多了,所配溶液的浓度会偏低;④容量瓶中原有少量蒸馏水,所配溶液的浓度无影响。
=18.4mol/L,设需要的浓硫酸额体积为Vml,根据溶液稀释定律C浓V浓=C稀V稀可知:18.4mol/L×Vml=0.5mol?L-1×500mL,解得V=13.6mL,根据“大而近”的原则,根据需要量取的浓硫酸的体积为13.6mL可知选用15mL量筒,故答案为:13.6;15;(4)在转移时应使用玻璃棒引流,需要洗涤烧杯2~3次是为了保证溶质完全转移;(5)①某学生观察定容时仰视液面,则加水的量偏多了,所配溶液的浓度会偏低,②未经冷却就直接定容配置将使浓度,待冷却后溶液体积偏小,则浓度偏高;③摇匀后发现液面低于刻度线再加水,则加水的量偏多了,所配溶液的浓度会偏低;④容量瓶中原有少量蒸馏水,所配溶液的浓度无影响。
考点:一定物质的量浓度溶液的配制
本题难度:一般
4、选择题 已知98%的浓硫酸的浓度为18.4mol.L-1,则49%的硫酸溶液的浓度为(硫酸溶液的浓度越大时,其溶液的密度越大)( )
A.9.2mol.L-1
B.大于9.2mol.L-1
C.小于9.2mol.L-1
D.无法确定
参考答案:设49%的硫酸溶液的浓度为为c,98%的浓硫酸的密度为ρ1,49%的硫酸溶液的密度为ρ2,
则18.4mol/L=1000ρ1×98%98,
c=1000ρ2×49%98,
由硫酸溶液的浓度越大时,其溶液的密度越大,
则ρ1>ρ2,
所以c<9.2mol.L-1,
故选C.
本题解析:
本题难度:一般
5、计算题 4.8 g镁与200 mL稀硫酸完全反应(反应前后溶液体积的变化忽略不计)。求产生的气体在标准状况下的体积和所得溶液中镁离子的物质的量浓度。
参考答案:H2? 4.48L(2分)? c(Mg2+)=" 1mol/L" (2分)
本题解析:略
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《离子共存》.. | |