|
高中化学知识点大全《物质的量》高频考点巩固(2020年模拟版)(六)
2021-06-11 06:25:28
【 大 中 小】
|
1、选择题 设NA代表阿伏加德罗常数,下列说法正确的是
A.含0.2NA个氮原子的氮气物质的量为0.1mol
B.标准状况下,18g水所具有的体积为22.4L
C.11.2L氦气所含的分子数目为0.5NA
D.1mol的NaCl溶解在1L的水中可以得到1mol/L的NaCl溶液
|
参考答案:A
本题解析:A、氮气是双原子分子,所以含有0.2NA个氮原子的物质的量是0.2NA/NA=0.2mol,则氮气物质的量为0.1mol,正确;B、18g水的物质的量是1mol,标准状况下,水不是气体,所以18g水的体积不是22.4L,错误;C、11.2L氦气的物质的量不一定是0.5mol,未指明标准状况,错误;D、1molNaCl溶于1L水中得到的溶液的体积不一定是1L,所以氯化钠溶液的浓度不一定是1mol/L,错误,答案选A。
考点:考查阿伏伽德罗常数与物质的量、气体体积、浓度的关系
本题难度:一般
2、选择题 与30mL 1mol/L的MgCl2溶液中Cl-浓度相同的是 (? )
A.150mL 0.2mol/L FeCl2溶液
B.90mL 2mol/L NaCl溶液
C.60mL 1mol/LAlCl3溶液
D.30mL 0.5mol/L CaCl2溶液
参考答案:B
本题解析:根据氯化镁的化学式可知,30mL 1mol/L的MgCl2溶液中Cl-浓度2mol/L,而在选项ABCD中,氯离子浓度分别是(mol/L)0.4、2、3、1,所以答案选B。
本题难度:一般
3、计算题 (5分)把1.0 mol·L—1 CuSO4溶液和a mol·L—1H2SO4溶液等体积混合(假设混合溶液的体积等于混合前两溶液的体积之和),混合液中c(SO42—)=1.5mol·L—1,试计算并填空。
(1)原溶液中a =______mol·L—1;混合液中c(Cu2+)=_____mol·L—1;c(H+)=_____ mol·L—1;
(2)向混合液中加入足量铁粉,经足够长时间并充分搅拌后,铁粉仍有剩余,假设反应后溶液体积不变(不考虑Fe2+被氧化),此时溶液中c(Fe2+)= ________mol·L—1。
参考答案:2.0(1分); 0.5(1分); 2.0(1分); 1.5(2分)
本题解析:(1)根据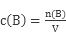 ,设取原溶液vL,由题意可知原溶液中a= ,设取原溶液vL,由题意可知原溶液中a=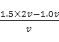 =2.0mol·L—1;混合液中c(Cu2+)=1.0v÷2v="0.5" mol·L—1;c(H+)=2av÷2v="2" mol·L—1;(2)向混合液中加入足量铁粉,,经足够长时间并充分搅拌后,铁粉仍有剩余,发生反应:Fe+Cu2+= Fe2++Cu、Fe+2H+= Fe2++H2↑,故此时溶液中c(Fe2+)=(1.0v+2.0v)÷2v="1.5" mol·L—1。 =2.0mol·L—1;混合液中c(Cu2+)=1.0v÷2v="0.5" mol·L—1;c(H+)=2av÷2v="2" mol·L—1;(2)向混合液中加入足量铁粉,,经足够长时间并充分搅拌后,铁粉仍有剩余,发生反应:Fe+Cu2+= Fe2++Cu、Fe+2H+= Fe2++H2↑,故此时溶液中c(Fe2+)=(1.0v+2.0v)÷2v="1.5" mol·L—1。
考点:物质的量浓度计算。
本题难度:一般
4、计算题 (12分)有一种可溶性氯化物、溴化物、碘化物的混合物,对其进行如下测定:
①称取试样5.00 g,溶于水后加入足量AgNO3溶液,使卤离子完全沉淀为卤化银,质量为3.57 g。将该卤化银加热并通入氯气使AgBr、AgI完全转化为AgCl后,其质量变为2.87 g。
②称取试样15.00 g,溶于水后加入氯化亚钯(PdCl2)处理后,其中只有碘化物转化为PdI2沉淀,该沉淀的质量为2.16 g。
请完成下列问题:
(1)步骤①称取的试样中,所有卤原子的物质的量之和是_____________mol,该试样中碘原子的物质的量是______________mol。
(2)列式计算原混合物中溴的质量分数和氯的质量分数
参考答案:(1)0.020 0 0.004(此处对有效数字不作要求)
(2)12.0% 6.03%
本题解析:(2) (Cl)+ (Cl)+ (Br)="0.020" mol-0.004 mol="0.016" mol (Br)="0.020" mol-0.004 mol="0.016" mol
 (AgCl)+ (AgCl)+  (AgBr)="3.57g-0.004" mol×235 g·mol-1="2.63" g (AgBr)="3.57g-0.004" mol×235 g·mol-1="2.63" g
 (Br)=(2.63 g-0.016 mol×143.5 g·mol-1)÷(80 g·mol-1-35.5 g·mol-1)="0.007" 51 mol (Br)=(2.63 g-0.016 mol×143.5 g·mol-1)÷(80 g·mol-1-35.5 g·mol-1)="0.007" 51 mol
 (Br)="0.007" 51 mol×80 g·mol-1÷5.00 g×100%=12.0% (Br)="0.007" 51 mol×80 g·mol-1÷5.00 g×100%=12.0%
 (Cl)="0.016" 0 mol-0.007 51 mol="0.008" 49 mol (Cl)="0.016" 0 mol-0.007 51 mol="0.008" 49 mol
 (Cl)="0.008" 49 mol×35.5 g·mol-1÷5.00 g×100%=6.03%。 (Cl)="0.008" 49 mol×35.5 g·mol-1÷5.00 g×100%=6.03%。
本题难度:简单
5、选择题 下列溶液中NO3?-的浓度与500 mL 0.4 mol·L-1 KNO3溶液中NO3-的浓度相等的是
A.50 mL 4 mol·L-1的KNO3溶液
B.1 L 0.2 mol·L-1的KNO3溶液
C.100 mL 0.2 mol·L-1的Ba(NO3)2溶液
D.500 mL 0.4 mol·L-1的Ba(NO3)2溶液
参考答案:C
本题解析:0.4 mol·L-1 KNO3溶液中NO3?的浓度为0.4 mol·L-1,A、B、C、D中NO3?的浓度分别为4 mol·L-1、0.2 mol·L-1、0.4 mol·L-1、0.8 mol·L-1。答案选C。
本题难度:一般
|