1、选择题 100 mL 6 mol·L-1H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量
A.碳酸钠溶液
B.水
C.硫酸钾溶液
D.硝酸钠溶液
参考答案:B C
本题解析:略
本题难度:简单
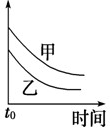
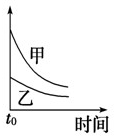
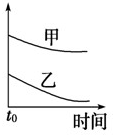
2、选择题 下列表格中的各种情况,可以用下面对应选项中的图象曲线表示的是( )
| 选项 | 反应 | 纵坐标 | 甲 | 乙
A
外形、大小相近的金属和水反应 | 反应速率
Mg
Na
B
4mL?0.01mol/L的KMnO4溶液,分别和不同浓度的H2C2O4(草酸)溶液各2mL反应
0.1mol/L的H2C2O4溶液
0.2mol/L的H2C2O4溶液
C
5mL?0.1mol/L?Na2S2O3溶液和5mL?0.1mol/L?H2SO4溶液反应
热水
冷水
D
5mL?4%的过氧化氢溶液分解放出O2
无MnO2粉末
加MnO2粉末
|
A.

B.
C.
D.
参考答案:A.Na比Mg活泼,反应速率快,则图象中乙应在上方,故A错误;
B.浓度大,反应速率快,则图象中乙应在上方,故B错误;
C.温度高,反应速率快,随反应的进行,正反应速率逐渐减小,甲的温度高,图中中应在上方,与图象一致,故C正确;
D.加催化剂,反应速率加快,则图中应乙在上上,故D错误;
故选C.
本题解析:
本题难度:简单
3、填空题 已知Fe3+与I-在水溶液中发生:2I-+2Fe3+=2Fe2++I2。该反应正反应速率和I-、Fe3+的浓度关系为v=kcm(I-)·cn(Fe3+)(其中k为常数)。
?
| cm(I-)(mol/L)m
| cn(Fe3+)[(mol/L)n]
| v[mol/(L·s)]
|
a
| 0.20
| 0.80
| 0.032
|
b
| 0.60
| 0.40
| 0.144
|
c
| 0.80
| 0.20
| 0.128
|
I-浓度对反应速率的影响________Fe3+浓度对反应速率的影响(填大于或小于或等于)
参考答案:大于
本题解析:将a和b中的数据带入v=kcm(I-)·cn(Fe3+)可知,m=n+1,所以I-浓度对反应速率的影响大于Fe3+浓度对反应速率的影响。
本题难度:一般
4、选择题 亚氯酸钠(NaClO2)是一种性能优良的漂白剂,但遇酸性溶液发生分解:5HClO2 4ClO2↑+H++Cl-+2H2O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,其原因可能是……(?)。
4ClO2↑+H++Cl-+2H2O。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,其原因可能是……(?)。
A.逸出ClO2使生成物浓度降低
B.酸使亚氯酸的氧化性增强
C.溶液中的H+起催化作用
D.溶液中的Cl-起催化作用
参考答案:D
本题解析:向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为硫酸,开始时反应缓慢,稍后一段时间产生气体速度较快,而盐酸于稀硫酸的不同之处在于酸根,这说明反应中生成的氯离子对反应起到催化剂的作用,答案选D。
点评:该题主要是考查学生对已知信息的提炼、归纳、总结和应用的能力,有利于培养学生的创新思维能力和应试能力,提高学生灵活运用基础知识解决实际问题的能力,属于中等难度的试题。
本题难度:一般
5、选择题 下列说法错误的是
A.在C(s) +H2O(g) 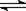 CO(g) + H2(g)反应体系中,增加碳的量不能迅速提高正反应速率
CO(g) + H2(g)反应体系中,增加碳的量不能迅速提高正反应速率
B.钾的金属性比钠强,所以钾与水的反应比钠的反应剧烈
C.在压强相同条件下,结构相似的CH4、SiH4、GeH4的沸点依次升高,所以结构相似的HF、HCl、HBr、HI的沸点也依次升高
D.面粉厂严禁烟火的原因是面粉粉尘表面积大,与空气接触遇明火极易发生爆炸
参考答案:C
本题解析:略
本题难度:简单