1、填空题 铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化亚铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)ΔH>0
2Fe(s)+3CO2(g)ΔH>0
①该反应的平衡常数表达式为:K=____________
②该温度下,在2L盛有粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为___________
(2)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v) 和温度(T)的关系示意图中与铝热反应最接近的是_________
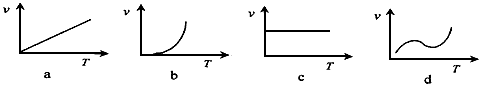
(3)Fe3+盐和Al3+盐在性质上有很多相似的地方,如遇碱都生成难溶的胶状沉淀,可用于净水;也有不同之处,如Fe3+既有氧化性又有还原性,Al3+只有氧化性。但Fe3+只有在碱性介质中才能被氧化为FeO42-,请完成下列方程式:?

(4)若将ag Fe和Al的混合物溶于2mol/L的足量的硫酸中,再往溶液中加入足量的6mol/L的NaOH溶液,充分反应,过滤,洗涤,干燥灼烧,称量所得固体的质量仍为ag,则原混合物中Al的质量分数为_________
参考答案:(1)①c3(CO2)/c3(CO);②0.015mol·L-1·min-1
(2)b (3)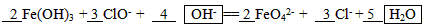 (4)30%
(4)30%
本题解析:
本题难度:一般
2、选择题 设C+CO2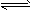 2CO-Q1(吸热反应)反应速率为u1,N2+3H2
2CO-Q1(吸热反应)反应速率为u1,N2+3H2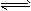 2NH3+Q2(放热反应)反应速率为u2,对于上述反应,当温度升高时,u1和u2的变化情况为
2NH3+Q2(放热反应)反应速率为u2,对于上述反应,当温度升高时,u1和u2的变化情况为
[? ]
A.同时增大
B.同时减小
C.增大,减小
D.减小,增大
参考答案:A
本题解析:
本题难度:简单
3、填空题 一密闭容器中发生下列反应:N2(g)+3H2(g)?2NH3(g);△H<0下图是某一时间段中反应速率与反应进程的曲线关系图.回答下列问题:
(1)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1______t3______t4______.
(2)下列时间段中,氨的百分含量最高的是______.
A.t0~t1B.t2~t3C.t3~t4D.t5~t6.
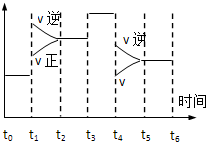
参考答案:由N2(g)+3H2(g)?2NH3(g)△H<0,可知,该反应为放热反应,且为气体体积减小的反应,则
(1)由图可知,t1正逆反应速率均增大,且逆反应速率大于正反应速率,改变条件应为升高温度;
t3正逆反应速率同等程度的增大,改变条件应为使用催化剂;
t4时正逆反应速率均减小,且逆反应速率大于正反应速率,改变条件应为减小压强,
故答案为:升高温度;
(2)由图可知,t1平衡逆向移动,t3不移动,t4平衡逆向移动,均使氨气的含量减少,则t0~t1氨气的含量最大,
故答案为:A.
本题解析:
本题难度:一般
4、选择题 反应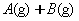

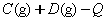 分别在673K和373K时进行,得C的体积分数和时间的关系曲线如下图所示,其中能正确表示此反应的图象是(?)。
分别在673K和373K时进行,得C的体积分数和时间的关系曲线如下图所示,其中能正确表示此反应的图象是(?)。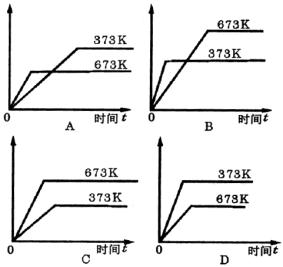
参考答案:A
本题解析:温度高,反应速率快,故673K时先达到平衡,且此反应为放热反应,故低温时(373K)C的体积分数要大。
本题难度:简单
5、选择题 把镁条投入到盛有盐酸的敞口容器中,下列因素对产生H2速率没有影响的是
A.Cl-的浓度
B.镁条的表面积
C.溶液的温度
D.H+的浓度