1、选择题 温度为T时,向2 L恒容密闭容器中充入1 mol PCl5,发生PCl5(g)  ?PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是
?PCl3(g) + Cl2(g)反应。反应过程中c(Cl2) 随时间变化的曲线如下图所示,下列说法不正确的是
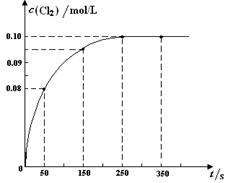
A.反应在0 ~50 s 的平均速率v(Cl2) =1.6×10-3mol/(L·s)
B.该温度下,反应的平衡常数K = 0.025
C.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,则该反应的ΔH <0
D.反应达平衡后,再向容器中充入 1 mol PCl5,该温度下再达到平衡时,0.1 mol/L<c(Cl2)<0.2 mol/L
参考答案:C
本题解析:A、反应在0 ~50 s 的平均速率v(Cl2) =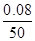 = 1.6×10-3 mol/(L·s),正确;B、平衡时C(Cl2)=0.1mol/L=C(PCl3),C(PCl5)=0.4mo/L,K = 0.025,正确;C升高温度,平衡时c(PCl3)=0.11mol/L,说明平衡向右移动,该反应是吸热反应,ΔH >0,错误;D、反应达平衡后,再向容器中充入 1 mol PCl5,各组分浓度都变为原来的2倍,增大压强,平衡逆向移动,所以0.1 mol/L<c(Cl2)<0.2 mol/L,正确。
= 1.6×10-3 mol/(L·s),正确;B、平衡时C(Cl2)=0.1mol/L=C(PCl3),C(PCl5)=0.4mo/L,K = 0.025,正确;C升高温度,平衡时c(PCl3)=0.11mol/L,说明平衡向右移动,该反应是吸热反应,ΔH >0,错误;D、反应达平衡后,再向容器中充入 1 mol PCl5,各组分浓度都变为原来的2倍,增大压强,平衡逆向移动,所以0.1 mol/L<c(Cl2)<0.2 mol/L,正确。
本题难度:一般
2、选择题 下图中,ψ(C)表示某反应物在体系中的质量分数,υ表示反应速率,p表示压强。下图为温度一定时反应速率与压强的关系曲线,右图为压强一定时ψ(C)与温度的关系曲线
同时符合以上两个图像的反应是:?(?)
A.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);△H=-808.7kJ·mol-1
4NO(g)+6H2O(g);△H=-808.7kJ·mol-1
B.N2O3(g)) NO2(g)+NO(g);△H=+41.8kJ·mol-1
NO2(g)+NO(g);△H=+41.8kJ·mol-1
C.3NO2(g)+H2O(l) NO(g)+2HNO3(l);△H=-261.8kJ·mol-1
NO(g)+2HNO3(l);△H=-261.8kJ·mol-1
D.CO2(g)+C(s) 2CO(g);△H=+171.4kJ·mol-1
2CO(g);△H=+171.4kJ·mol-1
参考答案:A
本题解析:由左图速率相等知道该反应已经达到平衡,当增大压强逆反应速率大于正反应速率,说明正反应体积增大。由右图温度升高反应物的质量分数增加,说明正反应是放热反应。综合判断答案为A
本题难度:一般
3、选择题 在一定条件下,一定量的A和B气体发生如下可逆反应:2A(g)+3B(g) 3C(g),只有反应到达平衡时才具有的状态是
3C(g),只有反应到达平衡时才具有的状态是
[? ]
A.各物质的浓度之比为2︰3︰3
B.混合物中各物质的浓度相等
C.A、B、C三种物质的浓度不随时间变化而变化
D.υ(A)︰υ(B)︰υ(C) = 2︰3︰3
参考答案:C
本题解析:
本题难度:一般
4、填空题 “洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。生产煤炭气的反应之一是:C(s)+H2O(g) CO(g)+H2(g)?131.4 kJ。
CO(g)+H2(g)?131.4 kJ。
(1)在容积为3L的密闭容器中发生上述反应,5min后容器内气体的密度增大了0.12g/L,用H2O表示0~5miin的平均反应速率为_________________________。
(2)能说明该反应已达到平衡状态的是________(选填编号)。
a.v正 (C)= v逆(H2O)?b.容器中CO的体积分数保持不变
c.c(H2)=c(CO)? d.炭的质量保持不变
(3)若上述反应在t0时刻达到平衡(如图),在t1时刻改变某一条件,请在右图中继续画出t1时刻之后正反应速率随时间的变化:
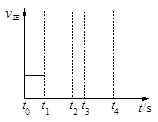
①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示)。
(4)在一定条件下用CO和H2经如下两步反应制得甲酸甲酯:
①CO(g) + 2H2(g)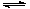 CH3OH(g)?②CO(g) + CH3OH(g)
CH3OH(g)?②CO(g) + CH3OH(g)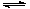 HCOOCH3(g)
HCOOCH3(g)
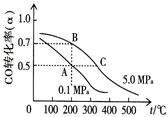
①反应①中CO的平衡转化率(α)与温度、压强的关系如图所示。在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是?。
②已知反应①中CO的转化率为80%,反应②中两种反应物的转化率均为85%,则5.04kgCO最多可制得甲酸甲酯?kg。
参考答案:(本题共10分)(1)0.002mol/(L·min)(2分) (2)b、d(2分)?
(3)(图略,合理给分)①t1时突增的u正渐增至t2时保持不变;②t3时突增的u正渐减至t4时保持不变(各1分)
(4)①降温、加压;将甲醇从混合体系中分离出来(2分)②4.08(2分)
本题解析:(1)5min后容器内气体的密度增大了0.12g/L,因此气体的质量增加了0.12g/L×3L=0.36g,根据方程式可知:C(s)+H2O(g)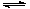 CO(g)+H2(g)?△m↑
CO(g)+H2(g)?△m↑
1mol? 12g
0.03mol? 0.36g
所以消耗水蒸气的物质的量浓度是0.03mol÷3L=0.01mol/L,因此用H2O表示0~5miin的平均反应速率为0.01mol/L÷5min=0.002mol/(L·min)。
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。a.碳是固体,不能用来表示,a不正确;b.容器中CO的体积分数保持不变,说明反应得到平衡状态,b正确;c.c(H2)=c(CO),但没有指明反应的方向,所以可逆反应不一定达到平衡状态,c不正确;d.炭的质量保持不变,说明正逆反应速率相等,反应达到平衡状态,d正确,答案选bd。
(3)①缩小容器体积,压强增大,反应速率增大。正方应是体积增大的可逆反应,所以平衡向逆反应方向移动,即正反应速率逐渐增大到锌平衡,因此曲线可以表示为 。
。
②t3时平衡常数K值变大,说明平衡向正反应方向移动。正方应是吸热反应,所以改变的条件是升高温度,因此正反应速率增大,然后逐渐减小到新平衡状态,所以曲线可以表示为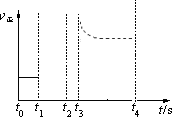 。
。
(4) ①根据图像可知,在压强相同时,温度越高,CO的转化率越低,这说明升高温度平衡向逆反应方向移动,因此正方应是放热反应。温度相同时,压强越大,CO的转化率越高,所以为提高CO的转化率可采取的措施是降温、加压或将甲醇从混合体系中分离出来。
②5.04kgCO的物质的量是5040g÷28g/mol=180mol。设参加反应①的CO物质的量是x,则参加反应②的CO物质的量是180mol-x。反应①中CO的转化率为80%,则反应中生成的甲醇物质的量是0.8x。在反应②中两种反应物的转化率均为85%,则0.8x×0.85=(180mol-x)×0.85,解得x=100mol,所以实际生成的甲酸甲酯的物质的量是0.8x×0.85=68mol,其质量是68mol×60g/mol=4080g=4.08kg。
本题难度:困难
5、选择题 在已处于化学平衡状态的体系中,下列哪个物理量发生变化,能表明平衡一定发生移动
[? ]
A.反应混合物的浓度
B.反应物的转化率
C.正、逆反应速率
D.反应混合物的压强
参考答案:B
本题解析:
本题难度:一般