1、选择题 下列微粒中,只具有氧化性的是
A.S
B.Na
C.Fe2+
D.Cu2+
参考答案:D
本题解析:分析:根据元素化合价的高低判断微粒的氧化性、还原性,最高价态的只有氧化性,最低价态的只有还原性,中间价态的既有氧化性又有还原性.
解答:A、硫元素的化合价处于中间价态,所以有氧化性和还原性,故A错误;
B、金属钠的化合价处于最低价态,所以有还原性,故B错误;
C、Fe2+的化合价处于中间价态,所以既有氧化性又有还原性,故C错误;
D、Cu2+的化合价处于最高价态,所以只有氧化性,故D正确;
故选D.
点评:本题考查了氧化还原反应的概念应用,判断微粒氧化性还原性的规律是:最高价态的只有氧化性,最低价态的只有还原性,中间价态的既有氧化性又有还原性.
本题难度:一般
2、选择题 在100mL含有等物质的量的HBr和H2SO3的溶液中通入0.01mol?Cl2,有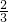 的Br?-转变为Br2(已知Br2能氧化H2SO3).则原溶液中HBr和H2SO3的物质的量浓度为
的Br?-转变为Br2(已知Br2能氧化H2SO3).则原溶液中HBr和H2SO3的物质的量浓度为
A.0.0075?mol?L-1
B.0.075?mol?L-1
C.0.008?mol?L-1
D.0.08?mol?L-1
参考答案:B
本题解析:分析:Br2能氧化H2SO3,则还原性H2SO3>Br-,氯气首先氧化H2SO3为H2SO4,H2SO3反应完毕,然后再氧化Br-,由于Br-部分转变Br2,所以HBr部分被氧化,H2SO3全部被氧化,令原溶液中HBr和H2SO3的浓度为cmol/L,根据电子转移守恒,列方程计算c的值.
解答:Br2能氧化H2SO3,则还原性H2SO3>Br-,氯气首先氧化H2SO3为H2SO4,H2SO3反应完毕,然后再氧化Br-,由于2/3的Br-转变Br2,所以有2/3HBr部分被氧化,H2SO3全部被氧化,令原溶液中HBr和H2SO3的浓度为cmol/L,根据电子转移守恒,则:
0.1L×cmol/L×(6-4)+0.1L×cmol/L×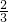 ×1=0.01mol×2,
×1=0.01mol×2,
解得:c=0.075,
故选B.
点评:本题考查氧化还原反应计算,难度中等,根据Br2能氧化H2SO3?判断还原性H2SO3>Br-是关键.
本题难度:困难
3、选择题 实验室欲配制一种仅含四种离子(不考虑来源于水电离的离子)的溶液,且溶液中四种离子的浓度均为1mol?L-1.能达到此目的是
A.Al3+、Cu2+、SO42-、Cl-
B.Mg2+、K+、SO42-、NO3-
C.ClO-、I-、K+、Na+
D.Mg2+、HCO3-、SO42-、OH-
参考答案:B
本题解析:分析:根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则能大量共存,并结合电荷守恒来解答.
解答:A.该组离子之间不反应,能共存,但四种离子的浓度均为1mol?L-1不遵循电荷守恒,故A不选;
B.该组离子之间不反应,能共存,且四种离子的浓度均为1mol?L-1遵循电荷守恒,故B选;
C.ClO-、I-发生氧化还原反应等,则不能大量共存,故C不选;
D.Mg2+、HCO3-、OH-结合生成沉淀、水,则不能共存,故D不选;
故选B.
点评:本题考查离子的共存,明确离子之间的反应及电荷守恒是解答本题的关键,注意选项C中的氧化还原为解答的难点,题目难度中等.
本题难度:一般
4、选择题 下列离子方程式书写正确的是
A.硫氢化钠溶液与碘反应:HS-+I2═S↓+2I-+H+
B.等物质的量浓度的FeBr2和CuCl2混合溶液用惰性电极电解最初发生的反应:Fe2++2Cl-?Fe+Cl2↑
C.石灰石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O
D.澄清石灰水中加入过量的Ca(HCO3)2溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O
参考答案:AD
本题解析:分析:A.硫氢化钠溶液与碘发生氧化还原反应生成碘化钠、S、HI;
B.电解最初铜离子、溴离子放电;
C.醋酸为弱酸,在离子反应中保留化学式;
D.澄清石灰水中加入过量的Ca(HCO3)2溶液生成碳酸钙沉淀、水.
解答:A.硫氢化钠溶液与碘反应的离子反应为HS-+I2═S↓+2I-+H+,故A正确;
B.等物质的量浓度的FeBr2和CuCl2混合溶液用惰性电极电解最初发生的反应的离子反应为
Cu2++2Br-? Cu+Br2,故B错误;
Cu+Br2,故B错误;
C.石灰石溶于醋酸的离子反应为CaCO3+2HAc═Ca2++CO2↑+H2O+2Ac-,故C错误;
D.澄清石灰水中加入过量的Ca(HCO3)2溶液的离子反应为Ca2++OH-+HCO3-═CaCO3↓+H2O,故D正确;
故选AD.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,并熟悉离子反应方程式的书写方法来解答,D为易错点,题目难度不大.
本题难度:一般
5、选择题 在水溶液中能大量共存的一组离子是
A.H+、K+、Cl-、CO32-
B.Ba2+、Mg2+、SO42-、Cl-
C.ClO-、I-、K+、Na+
D.Mg2+、K+、SO、NO
参考答案:D
本题解析:分析:如离子之间不发生任何反应,如生成沉淀、气体、弱电解质,或发生氧化还原反应、互促水解反应,则可大量共存.
解答:A.H+与反应而不能大量共存,故A错误;
B.Ba2+与SO42-反应生成沉淀而不能大量共存,故B错误;
C.ClO-与I-发生氧化还原反应而不能大量共存,故C错误;
D.离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评:本题考查离子共存问题,题目难度不大,注意把握离子的性质以及可能发生反应的类型,学习中注意积累.
本题难度:一般