1、简答题 氯化铍是用于制有机铍化合物和金属铍的重要原料.
(1)Be原子的基态价电子排布式为______,其元素的第一电离能______B元素(填“>”或“<”或“=”),原因是______.
(2)已知BeCl2加热易升华,液态BeCl2不导电,则BeCl2晶体类型为______;?BeCl2中Be原子的杂化轨道类型是______.
(3)Kraus用阴离子树脂交换法提取一种组成元素为氯和铍的阴离子,该阴离子内铍原子最外层达到8电子稳定结构,则该阴离子内存在的微粒间的作用力是______,阴离子的结构式为______.
参考答案:(1)Be原子的电子排布式为1s22s2,Be原子的基态价电子排布式为2s2.Be的2s轨道为全充满,稳定状态,体系能量低,第一电离能高于同周期相邻元素.
故答案为:2s2;>;Be的2s轨道全充满,体系能量低.
(2)BeCl2加热易升华,液态BeCl2不导电,则BeCl2晶体类型为分子晶体;BeCl2中Be原子成2个Be-Cl,Be原子的杂化轨道数为2,故Be原子采取?sp?杂化方式.
故答案为:分子晶体;?sp.
(3)阴离子内铍原子最外层达到8电子稳定结构,离子为BeCl42-,Be原子与氯原子之间通过共价键与配位键达8电子稳定结构,结构式为.
故答案为:共价键、配位键;
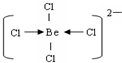
.
本题解析:
本题难度:一般
2、选择题 下列粒子中与NH4+具有相同质子数和电子数的是( )
A.Na+
B.F-
C.OH-
D.H2O
参考答案:NH4+中N原子的质子数为7,H原子的质子数为1,所以NH4+的质子数为11,电子数=11-1=10.
A、Na+中质子数为11,电子数=11-1=10,故A正确.
B、F-中质子数为9,电子数=9+1=10,故B错误.
C、OH-中质子数为9,电子数=9+1=10,故C错误.
D、H2O中质子数为10,电子数=质子数=10,故D错误.
故选A.
本题解析:
本题难度:一般
3、选择题 若某原子在处于能量最低状态时,外围电子排布式为4d35s2,则下列说法不正确的是( )
A.该元素原子最外层共有2个电子
B.该元素原子核外共有5个电子层
C.该元素原子的M能层共有18个电子
D.该元素原子处于能量最低状态时,原子中共有5个未成对电子
参考答案:D
本题解析:
本题难度:简单
4、选择题 某元素M层的电子数是L层电子数的
,则该元素的原子是( )
A.Li
B.S
C.Al
D.K
参考答案:L层上最多排8个电子,M层的电子数是L层电子数的34,所以M层上排6个电子,该原子核外共有2+8+6=16个电子,原子的核外电子数=原子的原子序数=16,所以该元素是S元素.
故选B
本题解析:
本题难度:一般
5、选择题 某元素的原子最外层电子数与电子层数相同,该元素单质和它与酸反应放出H2的物质的量之比为1:1,则该元素为( )
A.铍
B.镁
C.铝
D.钠
参考答案:A
本题解析:
本题难度:简单