1ΓΔΧνΩ’Χβ ≤Φ΅f≤Φ¬εΖ“ «“Μ÷÷œϊ―Ή’ρΆ¥ΒΡ“©ΈοΓΘΥϋΒΡΙΛ“ΒΚœ≥…¬ΖœΏ»γœ¬ΘΚ
«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
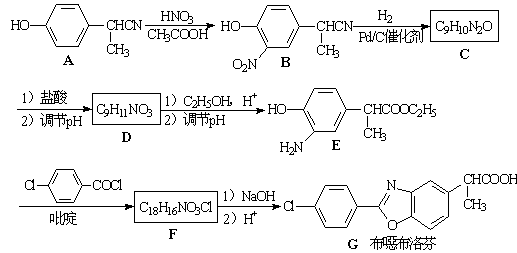
Δ≈A≥ΛΤΎ±©¬Ε‘ΎΩ’Τχ÷–Μα±δ÷ Θ§Τδ‘≠“ρ «ΓΘ
ΔΤ”–AΒΫBΒΡΖ¥”ΠΆ®≥Θ‘ΎΒΆΈ¬ ±Ϋχ––ΓΘΈ¬Ε»…ΐΗΏ ±Θ§ΕύœθΜυ»Γ¥ζΗ±≤ζΈοΜα‘ωΕύΓΘœ¬Ν–ΕΰœθΜυ»Γ¥ζΈο÷–Θ§ΉνΩ…Ρή…ζ≥…ΒΡ «ΓΘΘ®ΧνΉ÷ΡΗΘ©
aΘ° bΘ°
bΘ° cΘ°
cΘ°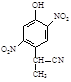 dΘ°
dΘ°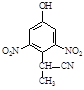
Δ«‘ΎEΒΡœ¬Ν–Ά§Ζ÷“λΙΙΧε÷–Θ§Κ§”– ÷–‘ΧΦ‘≠Ή”ΒΡΖ÷Ή” «ΓΘΘ®ΧνΉ÷ΡΗΘ©
aΘ° bΘ°
bΘ°
cΘ°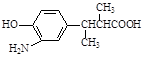 dΘ°
dΘ°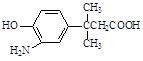
Δ»FΒΡΫαΙΙΦρ ΫΓΘ
Δ…DΒΡΆ§Ζ÷“λΙΙΧεH «“Μ÷÷ΠΝ-Α±ΜυΥαΘ§HΩ…±ΜΥα–‘KMnO4»ή“Κ―θΜ·≥…Ε‘±ΫΕΰΦΉΥαΘ§‘ρHΒΡΫαΙΙΦρ Ϋ «ΓΘΗΏΨέΈοL”…HΆ®ΙΐκΡΦϋΝ§Ϋ”Εχ≥…Θ§LΒΡΫαΙΙΦρ Ϋ «ΓΘ
≤ΈΩΦ¥πΑΗΘΚΔ≈Ζ”άύΜ·ΚœΈο“Ή±ΜΩ’Τχ÷–ΒΡO2―θΜ·ΔΤaΔ«ac
Δ»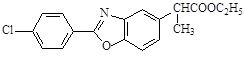
Δ…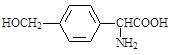
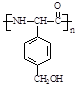 Μρ
Μρ
±ΨΧβΫβΈωΘΚΔ≈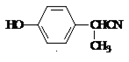 ÷–”–Ζ”τ«ΜυΘ§“Ή±Μ―θΜ·ΓΘ¥πΑΗΘΚΖ”άύΜ·ΚœΈο“Ή±ΜΩ’Τχ÷–ΒΡO2―θΜ·ΘΜΔΤΖ”τ«ΜυΒΡΝΎΈΜ“ΉΖΔ…ζ»Γ¥ζΘ§aΉνΩ…Ρή…ζ≥…Θ§¥πΑΗΘΚaΘΜΔ«”– ÷–‘ΧΦΒΡ «acΘ§ ÷–‘ΧΦ»γΆΦΘ§a
÷–”–Ζ”τ«ΜυΘ§“Ή±Μ―θΜ·ΓΘ¥πΑΗΘΚΖ”άύΜ·ΚœΈο“Ή±ΜΩ’Τχ÷–ΒΡO2―θΜ·ΘΜΔΤΖ”τ«ΜυΒΡΝΎΈΜ“ΉΖΔ…ζ»Γ¥ζΘ§aΉνΩ…Ρή…ζ≥…Θ§¥πΑΗΘΚaΘΜΔ«”– ÷–‘ΧΦΒΡ «acΘ§ ÷–‘ΧΦ»γΆΦΘ§a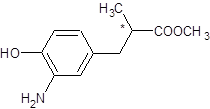 ,c
,c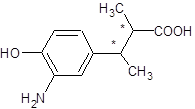 ΘΜΔ»FΈΣθΞ‘ΎΦν–‘ΧθΦΰœ¬Υ°ΫβΘ§ΒΟΒΫ―ΈΘ§ΥαΜ·Κσ…ζ≥…GΘ§FΈΣ
ΘΜΔ»FΈΣθΞ‘ΎΦν–‘ΧθΦΰœ¬Υ°ΫβΘ§ΒΟΒΫ―ΈΘ§ΥαΜ·Κσ…ζ≥…GΘ§FΈΣ ¥πΑΗΘΚ
¥πΑΗΘΚ ΓΘΔ…DΈΣ
ΓΘΔ…DΈΣ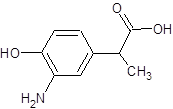 Θ§Ά§Ζ÷“λΙΙΧεH «“Μ÷÷ΠΝ-Α±ΜυΥαΘ§HΩ…±ΜΥα–‘KMnO4»ή“Κ―θΜ·≥…Ε‘±ΫΕΰΦΉΥαΘ§‘ρHΒΡΫαΙΙΦρ Ϋ «
Θ§Ά§Ζ÷“λΙΙΧεH «“Μ÷÷ΠΝ-Α±ΜυΥαΘ§HΩ…±ΜΥα–‘KMnO4»ή“Κ―θΜ·≥…Ε‘±ΫΕΰΦΉΥαΘ§‘ρHΒΡΫαΙΙΦρ Ϋ «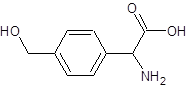 Θ§ΗΏΨέΈοL”…HΆ®ΙΐκΡΦϋΝ§Ϋ”Εχ≥…Θ§LΒΡΫαΙΙΦρ Ϋ «
Θ§ΗΏΨέΈοL”…HΆ®ΙΐκΡΦϋΝ§Ϋ”Εχ≥…Θ§LΒΡΫαΙΙΦρ Ϋ « Θ§¥πΑΗΘΚ
Θ§¥πΑΗΘΚ
 ΜρΓΘ
ΜρΓΘ
±ΨΧβΡ―Ε»ΘΚάßΡ―
2ΓΔ―Γ‘ώΧβ Ζ÷Ή” ΫΈΣC9H6O3Θ®÷Μ”–±ΫΜΖΕχ≤ΜΚ§ΤδΥϋΒΡΜΖΘ©ΒΡ”–ΜζΈο‘Ύ±ΫΜΖ…œΒΡ“Μ¬»»Γ¥ζΈο÷Μ”–“Μ÷÷ΒΡΫαΙΙ÷÷άύΈΣ?Θ®?Θ©
AΘ°2÷÷
BΘ°3÷÷
CΘ°4÷÷
DΘ°5÷÷
≤ΈΩΦ¥πΑΗΘΚB
±ΨΧβΫβΈωΘΚ¬‘
±ΨΧβΡ―Ε»ΘΚΦρΒΞ
3ΓΔ―Γ‘ώΧβ Ζ÷Ή” ΫΈΣC4H9ClΒΡΆ§Ζ÷“λΙΙΧεΙ≤”–Θ®?Θ©
AΘ°2÷÷
BΘ°3÷÷
CΘ°4÷÷
DΘ°5÷÷
≤ΈΩΦ¥πΑΗΘΚC
±ΨΧβΫβΈωΘΚΜ·ΚœΈοΨΏ”–œύΆ§Ζ÷Ή” ΫΘ§ΒΪΨΏ”–≤ΜΆ§ΫαΙΙΒΡœ÷œσΘ§Ϋ–ΉωΆ§Ζ÷“λΙΙœ÷œσΘΜΨΏ”–œύΆ§Ζ÷Ή” ΫΕχΫαΙΙ≤ΜΆ§ΒΡΜ·ΚœΈοΜΞΈΣΆ§Ζ÷“λΙΙΧεΓΘΖ÷Ή” ΫΈΣC4H9Cl¥”±ΞΚΆΕ»Ω¥÷ΜΡή «±ΞΚΆ¬»¥ζΆιΧΰΘ§Ά§Ζ÷“λΙΙ÷Μ «¬»‘ΎΧΦ…œΟφΝ§Ϋ”ΈΜ÷Ο≤ΜΆ§Εχ“―ΓΘ“ρΈΣΕΓΆι”–ΝΫ÷÷Ά§Ζ÷“λΙΙΧεΘ§Φ¥’ΐΕΓΆιΚΆ“λΕΓΆιΘ§Ζ÷Ή”÷–Κ§”–ΒΡΒ»–ß«β‘≠Ή”Ζ÷±πΕΦ «2÷÷Θ§‘ρΥϋΟ«“Μ¬»¥ζΈοΒΡ÷÷ ΐΦ¥ΈΣC4H9ClΒΡ÷÷ ΐΘ§’ΐΕΓΆιΝΫ÷÷“Μ¬»¥ζΈοΘ§“λΕΓΆιΝΫ÷÷“Μ¬»¥ζΈοΘ§Ι≤4÷÷Θ§¥πΑΗ―ΓCΓΘ
ΒψΤάΘΚΗΟΧβ «ΗΏΩΦ÷–ΒΡ≥ΘΦϊΧβ–ΆΘ§ τ”Ύ÷–Β»Ρ―Ε»ΒΡ ‘ΧβΓΘ÷ς“Σ «ΩΦ≤ι―ß…ζΕ‘Ά§Ζ÷“λΙΙΧεΚ§“ε“‘ΦΑ≈–ΕœΒΡ λœΛΝΥΫβ≥ΧΕ»Θ§”–άϊ”Ύ≈ύ―χ―ß…ζΒΡ¬ΏΦ≠ΆΤάμΡήΝΠΚΆΡφœρΥΦΈ§ΡήΝΠΓΘΗΟΧβΒΡΙΊΦϋ «Ϋχ––ΥΦΈ§ΉΣΜΜΘ§»ΜΚσ“άΨίΒ»–ß«β‘≠Ή”ΒΡ≈–ΕœΝιΜν‘Υ”ΟΦ¥Ω…ΓΘ
±ΨΧβΡ―Ε»ΘΚ“ΜΑψ
4ΓΔΦΤΥψΧβ ”–ΜζΈοA”…ΧΦΓΔ«βΓΔ―θ»ΐ÷÷‘ΣΥΊΉι≥…ΓΘœ÷»Γ3 g A”κ4.48 L―θΤχ(±ξΉΦΉ¥Ωω)‘ΎΟή±’»ίΤς÷–»Φ…’Θ§…ζ≥…Εΰ―θΜ·ΧΦΓΔ“Μ―θΜ·ΧΦΚΆΥ°’τΤχ(ΦΌ…ηΖ¥”ΠΈοΟΜ”– Θ”ύ)ΓΘΫΪΖ¥”Π…ζ≥…ΒΡΤχΧε“ά¥ΈΆ®ΙΐΉψΝΩΒΡ≈®ΝρΥαΚΆΦν ·Μ“Θ§≈®ΝρΥα‘ω÷Ί3.6 gΘ§Φν ·Μ“‘ω÷Ί4.4 gΓΘΜΊ¥πœ¬Ν–Έ ΧβΘΚ
(1)3 g A÷–ΥυΚ§«β‘≠Ή”ΓΔΧΦ‘≠Ή”ΒΡΈο÷ ΒΡΝΩΗς «Εύ…Ό?
(2)Ά®ΙΐΦΤΥψ»ΖΕ®ΗΟ”–ΜζΈοΒΡΖ÷Ή” ΫΓΘ
≤ΈΩΦ¥πΑΗΘΚ(8Ζ÷Θ©
(1)CΘΚ0.15 molΓΔHΘΚ0.4 molΘΜ(2)C3H8OΓΘ
±ΨΧβΫβΈωΘΚ(1)n(H)=2n(H2O)="0.4" mol
n(C)=n(CO2)+n(CO)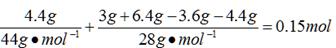 ΓΘ
ΓΘ
(2)3 g A÷–Θ§n(H)="0.4" molΘ§n(C)="0.15" mo1Θ§
n(O) =2n(CO2)+ n(CO)+ n(H2O)- 2n(O2)
=2ΓΝ0.1 mol+0.05mol+0.2mol-2ΓΝ0.2mol="0.05" mol
Υυ“‘Θ§n(C): n(H) :n(O)=3ΘΚ8ΘΚ1Θ§Ψ≠Ζ÷ΈωAΒΡΖ÷Ή” ΫΈΣC3H8OΓΘ
ΒψΤάΘΚ±ΨΧβΩΦ≤ι―ß…ζ”–ΜζΈοΖ÷Ή” ΫΒΡ»ΖΕ®÷Σ ΕΘ§ΉΔ“β‘≠Ή” ΊΚψΥΦœκΒΡΝιΜν”Π”Ο «ΙΊΦϋΘ§Ρ―Ε»≤Μ¥σΓΘ
±ΨΧβΡ―Ε»ΘΚ“ΜΑψ
5ΓΔ―Γ‘ώΧβ Χ«άύΓΔ÷§ΖΨΚΆΒΑΑΉ÷ «Έ§≥÷»ΥΧε…ζΟϋΜνΕ·ΒΡ»ΐ¥σ”Σ―χΈο÷ ΓΘœ¬Ν–”–ΙΊΥΒΖ®’ΐ»ΖΒΡ «
AΘ°»ΐ¥σ”Σ―χΈο÷ Ψυ τ”ΎΧλ»ΜΗΏΖ÷Ή”Μ·ΚœΈο
BΘ° ≥”ΟΒΡΒΑΑΉ÷ ΓΔΧ«ΚΆ”Ά÷§ΕΦΩ…ΖΔ…ζΥ°ΫβΖ¥”Π
CΘ°ΤœΧ―Χ«Φ»ΡήΖΔ…ζθΞΜ·Ζ¥”Π“≤ΡήΖΔ…ζ“χΨΒΖ¥”Π
DΘ°75%ΨΤΨΪ≥Θ”Ο”ΎœϊΕΨ «“ρΈΣΨΤΨΪ ΙœΗΨζΒΑΑΉΧεΖΔ…ζΝΥ±δ–‘
≤ΈΩΦ¥πΑΗΘΚCD
±ΨΧβΫβΈωΘΚAΓΔ”Ά÷§ΚΆΒΞΧ«“‘ΦΑΕΰΧ«Β»≤Μ τ”ΎΧλ»ΜΗΏΖ÷Ή”Μ·ΚœΈοΘ§A≤Μ’ΐ»ΖΘΜBΓΔΒΞΧ«≤ΜΡήΥ°ΫβΘ§B≤Μ’ΐ»ΖΘΜCΓΔΤœΧ―Χ«÷–Κ§”–τ«ΜυΚΆ»©ΜυΘ§“ρ¥ΥΤœΧ―Χ«Φ»ΡήΖΔ…ζθΞΜ·Ζ¥”Π“≤ΡήΖΔ…ζ“χΨΒΖ¥”ΠΘ§C’ΐ»ΖΘΜDΓΔ75%ΨΤΨΪ≥Θ”Ο”ΎœϊΕΨ «“ρΈΣΨΤΨΪ ΙœΗΨζΒΑΑΉΧεΖΔ…ζΝΥ±δ–‘Θ§D’ΐ»ΖΘ§¥πΑΗ―ΓCDΓΘ
±ΨΧβΡ―Ε»ΘΚ“ΜΑψ