1、选择题 在实验室制取Cl2的反应中,共收集到标准状况下的Cl2 8.96 L,则在此过程中发生转移的电子数目为()
A.6.02×1023
B.3.01×1023
C.2.408×1023
D.4.816×1023
参考答案:D
本题解析:n(Cl2)= =0.4 mol
=0.4 mol
n(e-)=0.4 mol×2=0.8 mol
N(e-)=0.8 mol×6.02×1023 mol-1=4.816×1023
本题难度:简单
2、选择题 某氯化镁溶液的密度为d g/cm3,其中镁离子的质量分数为w,a mL该溶液中Cl—的物质的量为:
A.mol
B.mol
C.mol
D.mol
参考答案:D
本题解析:略
本题难度:一般
3、选择题 用NA表示阿伏加德罗常数,下列说法正确的是
A.2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA
B.1mol Na2CO3晶体中含CO2- 3离子数小于1 NA
C.惰性电极电解食盐水,若线路中通过1 NA电子,则阳极产生气体11.2L
D.0.1 mol的CaO2中含阴离子数是0.2 NA
参考答案:A
本题解析:A、金属钠与过量的氧气反应无论加热与否,均失去一个e-,所以2.3 g金属钠(0.1mol)转移电子数均为0.1NA,正确;B、1mol Na2CO3晶体中含CO32-离子数应该等于1 NA,若在溶液中由于CO32-的水解,才小于1NA,错误;C、通过1 NA电子,阳极产生氯气在标准状况下为11.2L,错误;D、CaO2中含阴离子为O22-,所以0.1 mol的CaO2中含阴离子数是0.1 NA,错误。
本题难度:一般
4、填空题 现有铵盐样品A,是(NH4)2SO4、NH4HSO4的混合物。为确定A中各成分的含量,某研究性学习小组的同学取了数份相同质量的样品A溶于水,然后分别加入不同体积的1 mol/L的NaOH溶液,水浴加热至气体全部逸出(此温度下,铵盐不分解)。该气体干燥后用足量的浓硫酸完全吸收。浓硫酸增重的质量与加入NaOH溶液的体积的关系如图所示。分析该图象并回答下列问题:
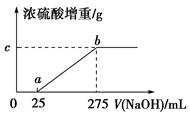
(1)写出ab段涉及的离子方程式:_____________________________。
(2)c点对应的数值是________;样品A中(NH4)2SO4、NH4HSO4的物质的量之比为________。
参考答案:(1)NH4++OH- NH3↑+H2O
NH3↑+H2O
(2)4.25 9∶2
本题解析:(1)(NH4)2SO4、NH4HSO4的混合溶液显酸性,加入NaOH溶液,先发生酸碱中和反应,再发生NH4++OH- NH3↑+H2O。(2)根据图象可知,NH3的物质的量为0.25 mol,质量为4.25 g,NH4HSO4的物质的量为0.025 mol,则(NH4)2SO4的物质的量为0.112 5 mol,(NH4)2SO4、NH4HSO4的物质的量之比为9∶2。
NH3↑+H2O。(2)根据图象可知,NH3的物质的量为0.25 mol,质量为4.25 g,NH4HSO4的物质的量为0.025 mol,则(NH4)2SO4的物质的量为0.112 5 mol,(NH4)2SO4、NH4HSO4的物质的量之比为9∶2。
本题难度:一般
5、计算题 盛有NO 和?NO2的混合气体的量筒倒立在盛有水的水槽中,过一段时间后,量筒内的气体体积减小为原来的一半。
(1)写出有关反应的化学方程式。
(2)原混合气体中NO和NO2的体积比是多少?
参考答案:(1)3NO2+H2O =?NO+2HNO3? (2分)
(2)1:3 (4分)
本题解析:(1)NO2通入水中,发生反应的方程式为:3NO2+H2O=2HNO3+NO。
NO2通入水中,发生:3NO2+H2O=2HNO3+NO,
设混合气体中含有xmolNO,ymolNO2,过一段时间后,量筒内的气体体积减小为原来的一半,则物质的量减小一半,
3NO2+H2O=2HNO3+NO
3?1
ymol ?y/3mol
则:(x+y/3)/(x+y) =1/2,
解之得:x:y=1:3。
点评:本题考查混合物的计算,题目难度不大,本题注意混合气体通入水中,体积减小的原因是二氧化氮与水反应的缘故,根据反应的化学方程式计算。
本题难度:一般