1、选择题 用固体NaOH配制一定物质的量浓度的NaOH溶液,下列操作正确的是
[? ]
A.称量时,将固体NaOH直接放在天平左边的托盘上
B.将称量好的固体NaOH直接放入容量瓶中,加蒸馏水溶解
C.定容时如果加水超过了刻度线,可用胶头滴管直接吸出多余部分
D.将烧杯中溶解固体NaOH所得溶液,冷却到室温后转移至容量瓶中
参考答案:D
本题解析:
本题难度:简单
2、选择题 把0.05mol醋酸分别加入到下列100mL溶液中,溶液的导电能力变化最明显的( )
A.0.5mol/LNaOH溶液
B.0.5mol/L盐酸
C.0.5mol/LNH4Cl溶液
D.0.5mol/L氨水
参考答案:A、100mL0.5mol/LNaOH溶液中加入0.05mol醋酸,得到100mL0.5mol/LNaAc溶液,离子浓度变化基本不变,则溶液的导电性不变,故A不选;
B、100mL0.5mol/L的盐酸溶液中加入0.05mol醋酸,得到100mL0.5mol/LHCl和0.5mol/L的醋酸溶液,但盐酸电离生成的氢离子抑制醋酸电离,离子的浓度比原来的大些,导电性比原来的强,故B不选;
C、100mL0.5mol/LNH4Cl溶液中加入0.05mol醋酸,得到100mL0.5mol/LNH4Cl和0.5mol/L的醋酸溶液,但NH4Cl电离生成的铵根离子抑制醋酸电离,离子的浓度比原来的大些,导电性比原来的强,故C不选;
D、因0.5mol/L氨水中存在电离平衡,电离的程度很弱,溶液中的离子浓度很小,导电性差,但0.05mol醋酸加入到100mL0.5mol/L氨水溶液中得到100mL0.5mol/LNH4Ac溶液,NH4Ac是强电解质,在水中完全电离,则离子浓度增大明显,导电性变化明显,故D选;
故选D.
本题解析:
本题难度:一般
3、选择题 某种氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数,下列说法正确的是
A.氯元素的相对原子质量是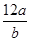
B.m g该氯原子的物质的量是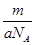 mol
mol
C.该氯原子的摩尔质量是a NA g/mol
D.a g该氯原子所含质子数是17NA
参考答案:BC
本题解析:A、核素的相对原子量的定义,a÷b/12=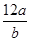 ,但氯元素含有同位素,相对原子质量应为同位素的计算值,错误;B、m g该氯原子的物质的量是m÷a÷NA,正确;C、摩尔质量数值为1mol原子的质量,正确;D、a g该氯原子所含质子数是a÷a×17 =17,错误。
,但氯元素含有同位素,相对原子质量应为同位素的计算值,错误;B、m g该氯原子的物质的量是m÷a÷NA,正确;C、摩尔质量数值为1mol原子的质量,正确;D、a g该氯原子所含质子数是a÷a×17 =17,错误。
本题难度:一般
4、选择题 设NA表示阿伏加德罗常数,下列有关说法正确的是
A.1.0 L 1 mol/L的NaNO3溶液中含有的氧原子数为3NA
B.30 g SiO2晶体中含有Si-O键数目为2NA
C.25℃时,pH=12的NaOH溶液中含有OH-的数目为0.01NA
D.1mol羟基与1molOH-离子所含电子数均为10NA
参考答案:B
本题解析:A.溶液中除了溶质含有氧元素外溶剂水也含有氧元素。所以氧原子数远远大于为3NA。错误。B.SiO2的摩尔质量是60g/mol,30 g SiO2晶体中含有SiO2的物质的量为0.5mol. 在SiO2晶体中每个硅原子与4个O原子形成4个Si-O键。所以0.5mol SiO2晶体中含有Si-O键数目0.5×4 NA=2NA.正确。数目为2NA C.25℃时,pH=12的NaOH溶液中NaOH电离产生的OH-的数目为0.01NA,此外还有水电离产生的OH-离子。故25℃时,pH=12的NaOH溶液中含有OH-的数目要大于0.01NA。错误。D.1mol羟基含电子数均为9NA与1molOH-离子所含电子数为10NA。错误。
本题难度:一般
5、选择题 相同温度时,下列溶液中导电能力最强的是
A.50mL 1.5mol/L 蔗糖溶液
B.100mL 1.0mol/L 醋酸溶液
C.50mL 0.5mol/L AlCl3溶液
D.100mL 0.5mol/L MgCl2溶液