1、选择题 常温下,将200ml pH=a的CuSO4和K2SO4的混合溶液用石墨电极电解一段时间,测得溶液的PH变为b(溶液体积的变化忽略不计),在整个电解过程中始终发现只有一个电极有气体产生。下列说法错误的是 (? )
A.若使电解质溶液恢复到电解前的浓度可向溶液中加入9.8×(10-b-10-a)g Cu(OH)2
B.b<a<7
C.阳极产生的气体是O2,其体积(标准状况下)为:1.12×(10-b-10-a)L
D.阴极电极反应式为:Cu2++2e-=Cu
参考答案:A
本题解析:本题考查了电解时离子的放电顺序,电极反应式,电解后溶液PH的变化及复原的方法和有关电解的计算,这也是历年高考试题常涉及的内容。本题的关键是看到在整个电解过程中始终发现只有一个电极有气体产生,马上就知道整个过程中是阳极产生氧气,阴极析出铜单质,D项正确,C项计算也正确;要恢复电解前的溶液就要将氧气和铜的质量转化为氧化铜或碳酸铜,所以不能加氢氧化铜,A项是错误的;考虑硫酸铜水解a<7,电解转变成酸则b<a,B项正确。
本题难度:一般
2、填空题 (7分)KMnO4是一种常用的强氧化剂,工业上常用电解法制备,总反应为2K2MnO4+2H2O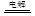 2 KMnO4+2KOH+H2↑。请回答下列问题:
2 KMnO4+2KOH+H2↑。请回答下列问题:
(1)电解时,分别用铂棒和铁棒作电极材料,其中铁棒为 (填“阳”或“阴”,下同)极材料。
(2)通电后,电解质溶液中K+ 向 极移动,MnO42- 向 极移动。
(3)电解一段时间后,向电解质溶液中滴加酚酞, 极呈红色。
(4)铂棒上发生 (填“氧化”或“还原”)反应,该极的电极反应式为 。
参考答案:(共7分,除电极反应式2分外,其余每空1分)
(1)阴 (2)阴;阳 (3)阴 (4)氧化 MnO42-?e-="=" MnO4-
本题解析:(1)电解时,分别用铂棒和铁棒作电极材料,根据方程式可知电解时锰酸钾失去电子转化为高锰酸钾,而铁电极是活性电极,则其中铁棒为阴极材料。
(2)电解池中阴极得到电子,则阳离子向阴极移动,因此通电后,电解质溶液中K+ 向阴极移动,MnO42- 向阳极移动。
(3)阴极是氢离子放电,产生氢气,同时产生氢氧根离子,因此电解一段时间后,向电解质溶液中滴加酚酞,阴极呈红色。
(4)铂棒是阳极,锰酸钾失去电子,发生氧化反应,该极的电极反应式为MnO42-?e-="=" MnO4-。
考点:考查电化学原理的应用
本题难度:一般
3、选择题 如图所示,下列叙述正确的是
[? ]
A.Y为阴极,发生还原反应
B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成
D.X与滤纸接触处变红
参考答案:A
本题解析:
本题难度:一般
4、填空题 工业上为了处理含有Cr2O72-酸性工业废水,采用下面的处理方法:往工业废水加入适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于排放标准。请回答下列问题:
?(1)两极发生反应的电极反应式:阴极:______________ 。阳极:______________ 。
?(2)写出Cr2O72-变为Cr3+离子方程式:_______________________ 。?
?(3)废水由酸性变为碱性的原因是_____________________________ 。
?(4)________(填“能”或“不能”)改用石墨电极,原因是_________________ 。
参考答案:
(1)Fe―2e-=Fe2+;2H++2e-=H2↑
(2)Cr2O72-+6Fe2++14H+ =2Cr3++6Fe3++7H2O
(3)H+不断在阴极上得电子成为H2而析出,且Cr2O72-与Fe2+的反应也在消耗H+,使得溶液酸性变为中性,再由中性变为碱性,Cr3++3OH-=Cr(OH)3↓, Fe3++OH-=Fe(OH)3↓
(4)不能;若改用石墨电极,阴极产物为Cl2,而不是Fe2+,没有Fe2+的还原作用, Cr2O72-就不能变为Cr3+,也就不能转化成Cr(OH)3沉淀而被除去。
本题解析:
本题难度:一般
5、选择题 工业品氢氧化钾溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。下列说法不正确的是
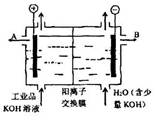
A.阴极材料可以是Fe,含氧酸根杂质不参与电极上放电
B.该电解槽的阳极反应式为:4OH―― 4e-= 2H2O+O2↑
C.通电后,该电解槽阴极附近溶液pH会减小
D.除去杂质后氢氧化钾溶液从出口B导出
参考答案:C
本题解析:该电解池反应的实质是电解水,阴极反应是2H2O+2e-=2OH-+H2↑,通电后阴极区的pH增大,阳极反应是2H2O-4e-=4H++O2↑,K+通过阳离子交换膜流向阴极与产生的OH-,以KOH溶液的形式从B口导出。由此可以得出A、B、D正确,C错误。选C。
本题难度:一般