1、填空题 单质碘与红磷在常温下混合不反应,但滴入几滴水后能剧烈反应,生成HI和H3PO3。但实验室制取氢碘酸的方法是把H2S通入I2水中,过滤生成的硫,可得质量分数为50%的氢碘酸
(1)写出实验室制取氢碘酸的化学方程式______________________;
(2)氢碘酸在空气中放置易易氧化变质,写出可能发生反应的化学方程式___________________________;
(3)为防止氢碘酸在空气中氧化变质,可在氢碘酸中加入少量___________,写出有关反应的化学方程式__________________________。?
(4)在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表:
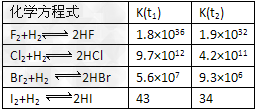
①已知t2>t1,HX的生成反应是__________?反应(填“吸热”或“放热”)。
②共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是_______________。
③仅依据K的变化,可以推断出:随着卤素原子核电荷数的增加,_________________(选填字母)。
a.在相同条件下,平衡时X2的转化率逐渐降低
b.X2与H2反应的剧烈程度逐渐减弱
c.HX的还原性逐渐减弱?
d.HX的稳定性逐渐减弱
参考答案:(1)I2+H2S==2HI+S↓
(2)4HI+O2==I2+2H2O
(3)红磷;3I2+2P+3H2O==6HI+2H3PO3
(4)①放热;②HF、HCl、HBr、HI;③ad
本题解析:
本题难度:一般
2、填空题 工业生产硝酸铵的流程图如下图。请回答
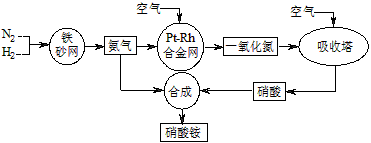
(1)已知:N2(g)+3H2(g)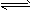 2NH3(g) ΔH=-92 kJ·mol-1。
2NH3(g) ΔH=-92 kJ·mol-1。
①在500℃、2.02×107Pa和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是______________________________。
②为有效提高氢气的转化率,实际生产中宜采取的措施有____________
A.降低温度 B.最适合催化剂活性的适当高温 C.增大压强
D.降低压强 E.循环利用和不断补充氮气 F.及时移出氨
(2) 已知铂铑合金网未预热也会发热。写出氨催化氧化的化学方程式:________________________,该反应的化学平衡常数表达式K=________________,当温度升高时,K值______(填“增大”、“减小”或“无影响”)。
(3)在一定温度和压强的密闭容器中,将平均相对分子质量为8.5的H2和N2混合,当该反应达到平衡时,测出平衡混合气的平均相对分子质量为10,请计算此时H2的转化率(写出计算过程)
___________________________________________
参考答案:(1)①<;在101KPa和298K条件下,1mol氮气和3mol氢气完全反应生成2mol氨气,放出92.4kJ热量,该反应为可逆反应,反应物不能全部变为生成物;又因为反应温度为500℃,所以放出的热量小于92.4kJ
②CEF
(2)4NH3+5O2 4NO+6H2O; K=
4NO+6H2O; K= ;减小
;减小
(3)设充入气体总量为1mol,氮气的物质的量为x,则氢气的物质的量为(1-x)。
则有: 28x+2(1-x)=8.5(或用十字交叉法)
解得:N2:x=0.25mol H2:1mol-0.25mol=0.75mol
又设平衡时N2转化的物质的量为y,则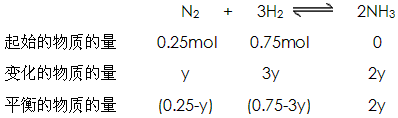 则有:
则有: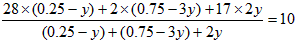
解得:y=0.075mol
则氢气的转化率为: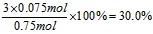
本题解析:
本题难度:困难
3、选择题
反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.下列判断正确的是( )
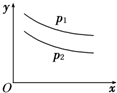
A.上述反应是放热反应
B.上述反应是吸热反应
C.a>b
D.a+1<b