1、填空题 (12分)【化学——物质结构与性质】
A、B、C、D、E是原子序数依次增大的五种元素。B元素原子最外层电子数比内层多3个,C、D元素同主族且原子序数D为C的二倍,E元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,回答下列问题。
(1)E元素基态原子的外围电子排布图为_______。
(2)元素B、C、D的第一电离能由小到大排列顺序为_______(用元素符号表示)。
(3) DC3冷凝可形成一种D、C相间的六元环结构的三聚体,其中D原子的杂化方式
为_______。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和1:2,
两种化合物可任意比互溶,其主要原因是________。
(5)A、B、C、D、E五种元素组成某配位化合物X,其原子个数比为18:6:4:1:1,
该配位化合物X的化学式为_________。
(6) Sb的一种氧化物高于843K时会转化为长链的大分子,
其结构片段如图,则该分子中Sb和O的原子个数比为_______ 。

参考答案:(12分)
(1) (2分)
(2分)
(2)S<O<N (2分)?
(3)sp3?(2分)
(4)H2O与H2O2之间形成氢键(2分)
(5)[Ni(NH3)6]SO4(2分)
(6)2∶3(2分)
本题解析:B元素原子最外层电子数比内层多3个,则B为N元素;C、D元素同主族且原子序数D为C的二倍,则C为O元素、D为S元素;E元素位于第四周期Ⅷ族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则E为Ni元素。
(1)E为Ni元素,基态原子的外围电子排布图为: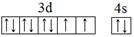
(2)元素B、C、D分别为N、O、S,N原子2p能级排布了3个电子,为半充满状态,较稳定,第一电离能大于O,所以第一电离能由小到大排列顺序为:S<O<N
(3)DC3冷凝可形成一种D、C相间的六元环结构的三聚体,则六元环上3个S和3个O依次交替,每个S再连接2个O,则每个S形成4个σ键,所以S原子的杂化方式为sp3
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和1:2,则A为H元素,两种化合物分别为H2O、H2O2,H2O与H2O2之间形成氢键,所以两种化合物可任意比互溶。
(5)A、B、C、D、E五种元素组成某配位化合物X,根据其原子个数比为18:6:4:1:1,可得化学式为:[Ni(NH3)6]SO4
(6)根据切割法,Sb位于公共边上,所以1个环含有Sb:4×1/2=2;位于上下顶点上的O只属于1个环,位于公共边上的O为2个环共用,所以1个环含有O:2×1/2+2=3,因此该分子中Sb和O的原子个数比为2:3。
本题难度:一般
2、选择题 根据元素周期表和元素周期律分析下面的推断,其中不正确的是?
A.硒(Se)化氢比硫化氢稳定
B.砹(At)的单质颜色为黑色
C.铍(Be)的原子失电子能力比镁弱
D.氢氧化镭[Ra(OH2)]比氢氧化钙的碱性强
参考答案:A
本题解析:同主族元素,从上往下,元素金属性逐渐减小,非金属性逐渐增大。故硒化氢不比硫化氢稳定,A错;卤族元素,从上往下,颜色逐渐加深,砹的单质颜色为黑色,正确。
点评:元素周期表及其规律是高考必考知识点,考生在备考中应注意积累掌握短周期元素的结构与性质。
本题难度:一般
3、选择题 下列叙述正确的是
A.第三周期元素的离子半径从左到右逐渐减小
B.ⅠA族元素的金属性一定比ⅡA族元素的金属性强
C.ⅦA族元素的气态氢化物中,稳定性最好的其沸点也最高
D.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
参考答案:C
本题解析:A选项中若比较钠离子的半径和氯离子的半径,则氯离子半径大于钠离子,不符合。B选项需先确定是同周期才能比较;C选项稳定性最好的是氟化氢,其沸点也最高,还需考虑到氢键的存在,正确。D选项氟和氧的最高化合价为0价,不等于族序数。
点评:本题涉及到了金属性、非金属性的比较;半径的比较,稳定性、沸点、最高正化合价的知识,都是元素周期律的基本知识点。归根结底是比较元素的金属性和非金属性,利用元素周期律来比较,处理好位、构、性三者之间的关系
本题难度:简单
4、填空题 写出下列四种粒子的符号并画出结构示意图:
(1)原子核外最外层电子数是次外层电子数3倍的原子__________________________。
(2)原子核外有三个电子层,最外层有7个电子的原子__________________________。
(3)相对原子质量为23,中子数为12的带1个单位正电荷的离子______________________。
(4)原子核外有35个电子的原子__________________________。
参考答案:(1)O?
(3)Na+?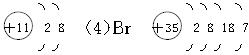
本题解析:要求学生熟记1—20号元素及其他典型金属元素和非金属元素的原子序数、元素符号等。画原子结构示意图要规范,其要点是:圆圈带核电,弧线呈扇面,数字一条线。
本题难度:简单
5、选择题 下列物质性质变化规律正确的是?(?)
A.O、F、H的原子半径依次减小
B.HI、HBr、HCl、HF的沸点依次降低
C.干冰、钠、冰的熔点依次降低
D.金属Na、Mg、Al的硬度依次降低
参考答案:A
本题解析:HF分子间存在氢键,HF的沸点高于HI的,B不正确;钠是金属晶体,熔点高于冰的,C不正确;金属Na、Mg、Al的硬度依次升高,D不正确,答案选A。
点评:该题是中等难度的试题,试题贴近高考,注重对学生能力的培养,有利于培养学生的逻辑思维能力。该题的关键是记住常见物质的性质递变规律,然后灵活运用即可。
本题难度:简单