1、实验题 (11分)铅蓄电池是典型的可充型电池,它的正负极隔板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2
 2PbSO4+2H2O
2PbSO4+2H2O
请完成下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是__________________;电解液中H2SO4的浓度将变__________________;当外电路通过1 mol电子时,理论上负极板的质量增加_________________g。
(2)在完全放电耗尽PbO2和Pb时,若按下图连接,电解一段时间后,则在A电极上生成_________________、B电极上生成_________________,此时铅蓄电池的正负极的极性将_________________。
2、选择题 一个原电池的总反应的离子方程式是Zn + Cu2+= Zn2+ + Cu,该反应的原电池的组成正确的是
?
| A
| B
| C
| D
|
正极
| Zn
| Ag
| Cu
| Cu
|
负极
| Cu
| Cu
| Zn
| Zn
|
电解质溶液
| CuCl2
| H2SO4
| CuSO4
| FeCl2
3、选择题 关于如图装置说法正确的是
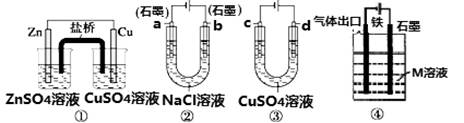
A.装置①中,盐桥中的K+移向ZnSO4溶液
B.装置②工作一段时间后,a极附近溶液的OH-的浓度增大
C.用装置③精炼铜时,c极为粗铜
D.装置④中若M是海水,该装置是通过“牺牲阳极保护法”使铁不被腐蚀
|
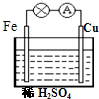
4、选择题 对于铁、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是
①Fe是负极?②电子由Fe经外电路流向Cu,后再通过溶液流回到Fe
③Fe-2e-=Fe2+? ④H+在溶液中由Cu棒向Fe棒迁移
⑤一段时间后溶液的PH变大?⑥一段时间后溶液由无色变为浅绿色( )
A.①②
B.①③⑤⑥
C.②③④
D.①②③④