1、简答题 某白色固体可能是Na2SO3、Na2SO4、Na2CO3中的两种或三种,化学兴趣小组在实验室对该固体进行探究:取少量固体滴加稀硫酸并将产生的气体通入澄清的石灰水后出现浑浊.一位同学由此得出该固体一定含有Na2CO3的结论.
(1)请指出该结论是否合理并说明理由______.
(2)请完成对该固体的探究:
①提出合理假设
假设1:______;假设2:______;假设3:______.
假设4:含有Na2SO3、Na2SO4和Na2CO3
②基于假设,设计出实验方案,在答题卷中画出装置图并描述实验操作、预期的实验现象和结论.
参考答案:(1)因为若固体是Na2SO3和Na2SO4滴加稀硫酸并将产生的气体通入澄清的石灰水后也会出现浑浊,
SO2+Ca(OH)2=CaSO3↓+H2O,所以该同学分析不合理;
故答案为:不合理 因为若固体是Na2SO3和Na2SO4滴加稀硫酸并将产生的气体通入澄清的石灰水后也会出现浑浊;
(2)①依据白色固体可能是Na2SO3、Na2SO4、Na2CO3中的两种或三种,结合假设4:含有Na2SO3、Na2SO4和Na2CO3,所以固体由两种物质的可能组成为:固体含有Na2SO3、Na2SO4;固体含有Na2SO3、Na2CO3;固体含有Na2SO4、Na2CO3;
故答案为:假设1:固体含有Na2SO3、Na2SO4;假设2;固体含有Na2SO3、Na2CO3;假设 3;固体含有Na2SO4、Na2CO3;
②根据假设继续实验设计的主要依据是,根据生成的气体性质进行验证、检验、分析、判断.由于二氧化硫和二氧化碳气体都和澄清石灰水反应生成沉淀变浑浊,所以在设计实验时,要考虑怎样验证二氧化硫气体,怎样验证二氧化碳气体,如何避免二氧化硫气体对二氧化碳气体检验的干扰,是解决本题的关键,所以设计思路为先用品红验证二氧化硫的存在,再用高锰酸钾溶液除去二氧化硫,用品红验证二氧化硫是否除净,最后通入澄清石灰水检验纯净的二氧化碳气体的存在,最后进行尾气的吸收;设计实验装置图和试剂如图所示:
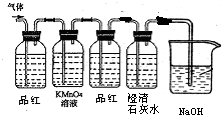
取少量固体滴加足量稀盐酸并将产生的气体通过上述装置,若看到第一个洗瓶的溶液腿色说明有Na2SO3,若第三个洗瓶的溶液颜色没有变化且第四个洗瓶中出现浑浊说明有Na2CO3;在与稀盐酸反应完的溶液中滴入BaCl2溶液若产生沉淀说明有Na2SO4;若第一个瓶褪色,第四个瓶变浑浊,反应液中加入BaCl2溶液产生沉淀,说明固体符合假设4;若第一个瓶褪色,第四个瓶无变化,反应液中加入BaCl2溶液产生沉淀,说明假设1符合;若第一个瓶无变化,第四个瓶变浑浊,反应液中加入BaCl2溶液产生沉淀,说明假设3符合;若第一个瓶褪色,第四个瓶变浑浊,反应液中加入BaCl2溶液无沉淀,则说明假设2符合;
故答案:

取少量固体滴加足量稀盐酸并将产生的气体通过上述装置,若看到第一个洗瓶的溶液腿色说明有Na2SO3,若第三个洗瓶的溶液颜色没有变化且第四个洗瓶中出现浑浊说明有Na2CO3;在与稀盐酸反应完的溶液中滴入BaCl2溶液若产生沉淀说明有Na2SO4;若第一个瓶褪色,第四个瓶变浑浊,反应液中加入BaCl2溶液产生沉淀,说明固体符合假设4;若第一个瓶褪色,第四个瓶无变化,反应液中加入BaCl2溶液产生沉淀,说明假设1符合;若第一个瓶无变化,第四个瓶变浑浊,反应液中加入BaCl2溶液产生沉淀,说明假设3符合;若第一个瓶褪色,第四个瓶变浑浊,反应液中加入BaCl2溶液无沉淀,则说明假设2符合;
本题解析:
本题难度:一般
2、选择题 下列对实验操作和实验事实的描述中不正确的是
A.中和滴定实验中,如用于盛放待测溶液的锥形瓶洗净后未干燥,不影响测定结果
B.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
C.测定溶液的pH时,可用洁净、干燥的玻璃棒蘸取溶液,滴在放置于干净表面皿的pH试纸上,再与标准比色卡比较
D.通过滤纸过滤可以得到Fe(OH)3胶体中的分散质粒子
参考答案:D
本题解析:分析:A.锥形瓶是否干燥,对实验无影响;
B.分液时应避免液体重复混合而污染;
C.根据pH试纸的使用方法判断;
D.胶体粒子可透过滤纸.
解答:A.实验室锥形瓶用于盛装待测液,实验过程中用蒸馏水冲洗锥形瓶内壁的滴定液,锥形瓶是否干燥,对实验无影响,故A正确;
B.分液时应避免液体重复混合而污染,下层液体从下口流出,上层液体从上口倒出,故B正确;
C.测定溶液的pH时,试纸不能直接插入到溶液中,且不能事先湿润,应用洁净、干燥的玻璃棒蘸取溶液,滴在放置于干净表面皿的pH试纸上,再与标准比色卡比较,故C正确;
D.胶体粒子可透过滤纸,应用半透膜,故D错误.
故选D.
点评:本题考查较为综合,涉及物质的分离、中和滴定以及试纸的使用等,侧重于化学实验方案的评价,为高考常见题型,综合考查学生的化学基本能力,注意相关实验操作方法和注意事项,题目难度不大.
本题难度:简单
3、选择题 下列实验操作与实验目的或结论都正确的是
[? ]
实验操作
实验目的或结论
A.
用干燥洁净的玻璃棒蘸取氯水点在pH试纸上,待其变色
后和标准比色卡比较
测氯水的pH
B.
室温下,分别向2支试管中加入相同体积、相同浓度的
Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸
研究浓度对反应速率的影响
C.
下层液体从分液漏斗下端管口放出后,关闭活塞,换一
个接收容器,再将上层液体从下端管口放出
取出分液漏斗中的上层液体
D.
向某溶液中加入稀硝酸,无现象,再滴加Ba(NO3)2溶
液,产生白色沉淀
说明该溶液中一定含有SO42-
参考答案:B
本题解析:
本题难度:一般
4、填空题 某白色粉末由碳酸钠、硝酸镁、硫酸铜、氯化钠中的一种或几种组成.为了检验它们做了以下实验,将表格补充完整,并回答问题.
| 实验操作 | 实验现象 | 结论
①取部分粉末,加水溶解.将所得溶液
分成三份,分别进行实验②③④
得无色溶液
②滴加稀硫酸
无明显现象
③滴加氢氧化钠溶液
出现白色沉淀
④加入足量AgNO3溶液
含有NaCl
|
写出③和④中反应的离子方程式:③______;④______.
参考答案:①取部分粉末,加水溶解.将所得溶液为无色溶液,证明不含硫酸铜;
②滴加稀硫酸无明显现象,证明不含碳酸钠;
③滴加氢氧化钠溶液出现白色沉淀,证明一定含有硝酸镁;
④加入足量AgNO3溶液出现白色沉淀证明含有氯化钠;
实验操作实验现象结论?不含CuSO4?不含Na2CO3?含有Mg(NO3)2?出现白色沉淀?依据判断结合反应过程写出离子反应;③是氢氧化钠和硝酸镁反应生成氢氧化镁沉淀的过程,反应的离子方程式为:Mg2++2OH-=Mg(OH)2↓;?④加入硝酸银溶液和氯化钠反应生成氯化银沉淀,反应的离子方程式为:Ag++Cl-=AgCl↓;
故答案为:Mg2++2OH-=Mg(OH)2↓;?Ag++Cl-=AgCl↓;
本题解析:
本题难度:一般
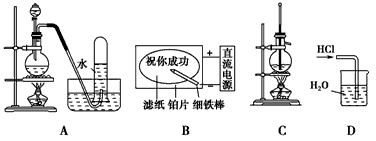
5、选择题 用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是
[? ]
A.二氧化锰与浓盐酸反应制干燥氯气
B.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用外加保护膜的细铁棒做笔在滤纸上写字显红色字迹
C.石油的分馏
D.用水吸收氯化氢气体
参考答案:B
本题解析:
本题难度:一般