1、选择题 为了除去粗盐中的Ca2+,Mg2+,SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序 ①过滤; ②加过量NaOH溶液; ③加过量盐酸; ④加过量NaCO3溶液; ⑤加过量
BaCl2溶液
[? ]
A.④②⑤
B.②⑤④①③
C.④①②⑤③
D.①④②⑤③
参考答案:B
本题解析:
本题难度:一般
2、选择题 下列说法正确的是
A.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液
B.氨基酸是人体必需的营养物质,其晶体主要以内盐形式存在,调节溶液的pH可改变它的溶解度
C.在苯酚和乙醇性质比较实验中,将等物质的量的乙醇和苯酚置于试管中,再投入金属钠,从而可以比较出羟基氢的活泼性
D.抽滤完毕,直接用玻璃棒刮下布氏漏斗中滤纸上的固体
参考答案:B
本题解析:A.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量CuSO4溶液,由于Zn比Cu活泼,发生置换反应Zn+Cu2+=Zn2++Cu。产生的Cu附着在Zn的表面,就形成了Cu、Zn原电池,所以可以加快氢气的反应速率。但是若加入Cu(NO3)2溶液,就相当于CuSO4溶液和HNO3混合。由于HNO3有强氧化性,所以一般不能产生氢气。错误。B.氨基酸是人体必需的营养物质,其晶体主要以内盐形式存在,氨基酸是弱酸,若调节溶液的pH,就可改变使氨基酸的电离平衡发生移动,进而影响它的溶解度。正确。C.苯酚和乙醇都能与Na发生反应置换出氢气,所以不能比较出羟基氢的活泼性的强弱。错误。D.抽滤完毕滤纸上的固体要等到干燥后用玻璃棒剥下来。错误。
本题难度:一般
3、选择题 下列实验操作或方法不能达到实验目的的是
[? ]
实验目的?
实验操作或方法
A.
分离苯和水?
分液
B.
从海水中提取淡水?
蒸馏
C.
提取碘水中的碘?
用酒精萃取
D.
分离硝酸钾和沙子
溶解后过滤
参考答案:C
本题解析:
本题难度:简单
4、选择题 能够用来鉴别NH4Cl、NaCl、Na2CO3三种物质的试剂是(?)
A.AgNO3溶液
B.Ba(OH) 2溶液
C.稀盐酸
D.NaOH溶液
参考答案:B
本题解析:NH4Cl?与Ba(OH) 2溶液反应,产生具有刺激性的气体氨气,NaCl?与Ba(OH) 2溶液反应不反应,Na2CO3与Ba(OH) 2溶液反应,产生白色沉淀Ba CO3。
本题难度:一般
5、实验题 研究性学习小组对某硫酸亚铁晶体(FeSO4?xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。
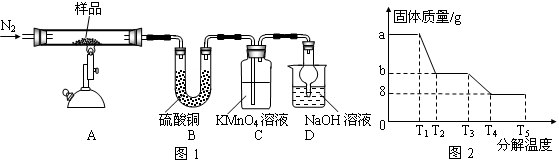
(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有??。
(2)实验中要持续通入氮气,否则测出的x会??(填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式??。
(5)装置D球形干燥管的作用??。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4?xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4?xH2O中的x=???。
参考答案:(1)SO2,?(2)偏小
(4)2FeSO4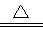 Fe2O3+SO2↑+SO3↑?(5)防止氢氧化钠溶液倒吸?(6)x= 7
Fe2O3+SO2↑+SO3↑?(5)防止氢氧化钠溶液倒吸?(6)x= 7
本题解析:解:(1)二氧化硫能使高锰酸钾溶液褪色,故答案为:二氧化硫。
(2)实验中要持续通入氮气,把水蒸气全部赶出,否则测出的x会偏小,故答案为:偏小。
(3)硫酸亚铁晶体加热会失去结晶水,高温会继续分解产生金属氧化物和非金属氧化物,结合A中固体呈红棕色,放入足量稀盐酸,固体全部溶解,得到黄色溶液的信息,因此A中红棕色固体是氧化铁;故为氧化铁。
(4)FeSO4的分解产物是Fe2O3、SO2、SO3,配平即可,故答案为:2FeSO4 Fe2O3+SO2↑+SO3↑。
Fe2O3+SO2↑+SO3↑。
(5)装置D球形干燥管的作用是:干燥气体的作用并防止氢氧化钠溶液倒吸,故答案为:干燥气体的作用并防止氢氧化钠溶液倒吸。
(6)通过FeSO4·xH2O的化学式可知铁原子和水的个数比为1:2x,
Fe2O3~2xH2O
160? 36x
8g? 12.6g
x=7
故答案为:7。
本题难度:一般