1、选择题 几年前,日本的畈岛教授研究发现了碳纳管,这种碳纳管在目前的无机非金属材料中有着广泛的应用。其存在可称为第五种纯碳形态,下列不是纯碳形态的是(?)
A.金刚石
B.石墨
C.煤
D.C60
参考答案:C
本题解析:煤是由多种物质组成的混合物。
本题难度:简单
2、实验题 (2014届四川省眉山市高三第一次诊断性考试化学试卷)
根据Mg能在CO2中燃烧,某兴趣小组推测Na应该也能在CO2中燃烧,且固体产物可能为C、Na2O和Na2CO3中的两种或三种。该小组用如下图装置进行了实验探究。已知PdCl2能被CO还原得到黑色的Pd。
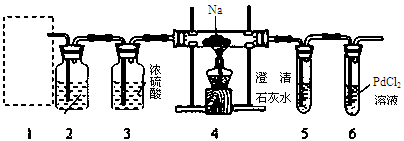
回答下列问题:
(1)为了使反应随开随用,随关随停,上图虚线方框内应选用?装置(填下图字母代号),如何检验所选装置的气密性?。
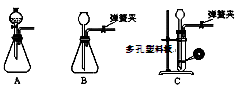
(2)装置2中所盛试剂为?。
A.NaOH溶液?B.饱和NaHCO3溶液
C.饱和Na2CO3溶液?D.饱和NaCl溶液
(3)检测装置的气密性完好并装好药品后,在点燃酒精灯前应先进行装置1中的反应操作,待观察到?现象时,再点燃酒精灯,这步操作的目的是?。
(4)由实验现象和进一步的探究得出反应机理。
A.装置6中有黑色沉淀生成;
B.取反应后直玻管中的固体物质23.0g溶于足量的水中,无气泡产生且得到澄清的溶液;将溶液加水稀释配成250 mL的溶液;
C.取25.00ml步骤B的溶液,滴加足量BaCl2溶液,将生成的白色沉淀过滤、洗涤、干燥,称量得固体质量为1.97g。
①步骤C中不溶物干燥前必须经过洗涤,如何检验该沉淀是否洗涤干净?。
②该探究得出钠与二氧化碳反应的化学方程式为?。
参考答案:(1)C(2分),关闭弹簧夹,向长颈漏斗中加水,一定时间后静置液面保持不动,说明气密性良好(2分)
(2)B(2分)
(3)装置5中出现大量混浊(2分);排尽装置中的空气(2分)
(4)①取最后一次洗涤液加入稀H2SO4,不出现浑浊说明沉淀洗涤干净(2分)
②6Na+4CO2 2Na2O+Na?2CO3+3CO(2分)
2Na2O+Na?2CO3+3CO(2分)
本题解析:
C装置是采用固液分开的设计,打开弹簧夹液体加入反应开始,关闭弹簧夹反应产生气体的压强使固液分开反应停止;检验有多个出口的实验装置的气密性,一般只保留一个封住其它出口进行实验,关闭弹簧夹,向长颈漏斗中加水,一定时间后静置液面保持不动,说明气密性良好;(2)装置C是用石灰石或大理石与盐酸反应产生二氧化碳,会混有HCl杂质,故2用饱和NaHCO3溶液来除去HCl同时转化为二氧化碳;(3)CO易燃,混有空气可能会发生爆炸,反应前需先同二氧化碳除去装置中的空气,当观察到5中石灰水变浑浊时认为装置中充满二氧化碳,空气排尽;(4)检验洗涤是否干净,一般是要取最后次的洗涤液,进行检验可能存在的杂质离子,鉴于洗涤液中离子浓度较低,一般检验比较容易出现现象的离子如硫酸根离子、氯离子等;
根据实验现象知产物物碳单质,无钠剩余,根据碳酸钡的质量计算出
n(Na?2CO3)= n(BaCO3)=1.97÷197×10=0.1mol
m(Na?2CO3)= 0.1×106=10.6g
所以固体中含有氧化钠n(Na?2O)=(23.0-10.6)÷62=0.2mol
根据氧化还原反应原理,反应中碳元素化合价下降为+2价CO,方程式为
6Na+4CO2 2Na2O+Na?2CO3+3CO
2Na2O+Na?2CO3+3CO
本题难度:一般
3、选择题 有些科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列关于硅的说法不正确的是(?)
A.自然界硅元素的贮量丰富
B.硅可用于制造光导纤维
C.高纯度的单质硅被广泛用于制作计算机芯片
D.硅可由二氧化硅还原制得
参考答案:B
本题解析:略
本题难度:简单
4、推断题 A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如下图所示。A为地壳含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。

请填空:
(1)形成单质A的原子的结构示意图为?,它的最高化合价为?。
(2)B的化学式(分子式)为?。B和碳反应生成A和E的化学方程式是?。
(3)C的化学式(分子式)为?,D晶体中化学键类型有?。
(4)设计实验比较碳和A的非金属性强弱(用离子方程式表示)??。
参考答案:(1)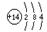 ?+4?
?+4?
(2) SiO2?2C+SiO2 2CO↑+Si?
2CO↑+Si?
(3) CaSiO3?离子键、极性键
(4)SiO32-+CO2+H2O=H2 SiO3+CO32-
本题解析:A为地壳含量仅次于氧的非金属元素的单质,故A为Si,B、C、D、E分别为 SiO2、CaSiO3、NaSiO3、CO。所以(1)形成单质A的原子的结构示意图为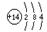 ,最高化合价为+4 ,(2)B的化学式(分子式)为SiO2,B和碳反应生成A和E的化学方程式是2C+SiO2
,最高化合价为+4 ,(2)B的化学式(分子式)为SiO2,B和碳反应生成A和E的化学方程式是2C+SiO2 2CO↑+Si ,注意是CO不是CO2,3)C的化学式(分子式)为CaSiO3?,D为NaSiO3,其晶体中化学键类型有离子键、极性键;(4)可以利用强酸制备弱酸的方法比较两者的非金属性的强弱,其离子方程式为SiO32-+CO2+H2O=H2 SiO3+CO32-。
2CO↑+Si ,注意是CO不是CO2,3)C的化学式(分子式)为CaSiO3?,D为NaSiO3,其晶体中化学键类型有离子键、极性键;(4)可以利用强酸制备弱酸的方法比较两者的非金属性的强弱,其离子方程式为SiO32-+CO2+H2O=H2 SiO3+CO32-。
点评:本题考查了Si及其化合物,是高考的重要考点,该题难度适中。
本题难度:一般
5、选择题 下列物质的用途错误的是
A.硅是制造太阳能电池的常用材料
B.常温下可用铁罐或铝罐装运稀硝酸
C.小苏打和氢氧化铝均可治疗胃酸过多
D.工厂废气中的SO2可回收生产硫酸
参考答案:B
本题解析:A正确,硅能够将太阳能转化为电能的材料;B错,常温下可用铁罐或铝罐装运浓硝酸,发生钝化;C正确,胃酸的主要成分为HCL,小苏打和氢氧化铝的碱弱较弱可以作为胃药的成分;D正确,工厂废气中的SO2可回收生产硫酸既可以消除对环境的影响,又可废物利用;
本题难度:一般