1、选择题 下列反应能表明SiO2具有微弱氧化性的是(?)
A.SiO2+2NaOH====Na2SiO3+H2O
B.SiO2+Na2CO3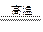 Na2SiO3+CO2↑
Na2SiO3+CO2↑
C.SiO2+2C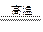 Si+2CO↑
Si+2CO↑
D.SiO2+4HF====SiF4↑+2H2O
2、推断题 A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如下图所示。A为地壳含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。

请填空:
(1)形成单质A的原子的结构示意图为?,它的最高化合价为?。
(2)B的化学式(分子式)为?。B和碳反应生成A和E的化学方程式是?。
(3)C的化学式(分子式)为?,D晶体中化学键类型有?。
(4)设计实验比较碳和A的非金属性强弱(用离子方程式表示)??。
3、选择题 固体熔化时必须破坏非极性共价键的是? (? )
A.冰
B.晶体硅
C.溴
D.二氧化碳
4、选择题 下列说法正确的是?(?)
A.二氧化硅用来制造通讯材料一光导纤维
B.沙子、石英的主要成分是单质硅
C.SiO2可与盐酸发生反应
D.自然界里大量存在单质硅、二氧化硅和硅酸盐
5、填空题 硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号?,该能层具有的原子轨道数为?、电子数为?。
(2)硅主要以硅酸盐、?等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以?相结合,其晶胞中共有8个原子,其中在面心位置贡献?个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,该反应的化学方程式为?。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
化学键
| C-C
| C-H
| C-O
| Si-Si
| Si-H
| Si-O
|
键能(KJ/mol)
| 356
| 413
| 336
| 226
| 318
| 452
|
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是?。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是?。
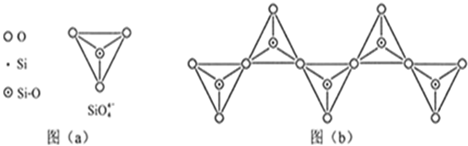
(6)在硅酸盐中,SiO44-四面体(如下图a)通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图b为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为?。Si与O的原子数之比为?化学式为?。