|
高考化学知识点总结《胶体》试题预测(2020年最新版)(二)
2021-06-11 06:49:25
【 大 中 小】
|
1、选择题 下列现象与胶体的性质无关的是
[? ]
A.将盐卤或石膏加入豆浆,制成豆腐
B.一枝钢笔使用两种不同型号的蓝黑墨水,易出现堵塞
C.向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀
D.清晨,人们经常看到的阳光穿过茂密的树木枝叶所产生的美丽景象
参考答案:C
本题解析:
本题难度:简单
2、选择题 下列说法中,正确的是
A.稀硫酸不具有氧化性
B.NH4Cl中只含有离子键
C.可用丁达尔效应区分溶液和胶体
D.金属阳离子被还原时一定得到金属单质
|
参考答案:C
本题解析:A、稀硫酸中H元素的化合价处于最高价+1价,可以得到电子,表现氧化性,如Zn与稀硫酸反应,A错误;B、氯化铵离子化合物,含有离子键,但还含有N-H共价键,B错误;C、胶体具有丁达尔现象,而溶液没有,可用丁达尔效应区分溶液和胶体,C正确;D、金属氧离子被还原,可能得到金属阳离子,如铁离子被还原铜还原为亚铁离子,D错误,答案选C。
考点:考查氧化还原反应的应用
本题难度:一般
3、填空题 如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号.请回答下列问题:
(1)请将分类依据代号填入相应的括号内:
______两种物质都不是电解质
______两种物质都是钠的化合物
______两种物质都是氧化物
______两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入上图中某种物质M的饱和溶液,继续煮沸可制得一种红褐色胶体.
①物质M的名称为______.
②下列关于M的水溶液和上述操作所得胶体的叙述,正确的是______
A.M的水溶液是电中性的,所得胶体是带电的
B.二者分散质的粒子都不能透过半透膜
C.二者可用丁达尔效应区别
D.加入盐酸二者都会先产生沉淀,后沉淀溶解.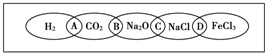
参考答案:(1)氢气属于单质,电解质必须是化合物,不属于电解质的范畴,二氧化碳的水溶液能导电,是生成的碳酸导电,二者不属于电解质,
含有钠元素的化合物是氧化钠和氯化钠,二氧化碳和氧化钠中有两种元素组成,一种是氧元素,属于氧化物,氯化钠和氯化铁是能电离出酸根阴离子和金属阳离子的化合物,属于盐类,故答案为:A、C、B、D;
(2)①用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入氯化铁的饱和溶液,继续煮沸可制得一种红褐色氢氧化铁胶体,故答案为:氯化铁;
②A、胶体和溶液均是电中性的,故A错误;
B、溶液中的离子可以通过半透膜,胶体中的微粒不能,故B错误;
C、胶体具有丁达尔现象,溶液没有,丁达尔现象可以鉴别溶液和胶体,故C正确;
D、胶体中加入电解质会发生聚沉,氢氧化铁可以和酸发生中和反应,氢氧化铁加入盐酸二者会先产生沉淀氢氧化铁,后沉淀溶解,但是溶液不具备聚沉的性质,故D错误.
故选C.
本题解析:
本题难度:一般
4、填空题 (15分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:

已知:① 2KOH + Cl2 =" KCl" + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 =" 5KCl" + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4可作为新型多功能水处理剂的原因 ;
(4)与MnO2 — Zn电池类似,K2FeO4 — Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________,该电池总反应的离子方程式为_____。
(5)在“反应液I ”中加KOH固体的目的是① ,② ;
(6)从“反应液II ”中分离出K2FeO4后,副产品是 (写化学式)。
参考答案:(1)温度较低(2)2NaCl + 2H2O  2NaOH + H2↑ + Cl2↑ 2NaOH + H2↑ + Cl2↑
(3)+6价的Fe元素易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉。
(4)FeO42-+3e-+4H2O= Fe(OH)3+5OH-;2FeO42-+8H2O+3Zn= 2Fe(OH)3+ 3Zn(OH)3+4OH-
(5)与“反应液I”中过量的Cl2继续反应,生成更多的KClO;为下一步反应提供反应物
(6)KNO3 KCl
本题解析: (1)根据反应方程式可知:该生产工艺应在温度较低的情况下进行;(2)在工业上一般用电解法制取氯气。制取Cl2的化学方程式为2NaCl + 2H2O  2NaOH + H2↑ + Cl2↑。(3)K2FeO4中的Fe+6价,易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉。因此可作为新型多功能水处理剂。(4)K2FeO4 — Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式是FeO42-+3e-+4H2O= Fe(OH)3+5OH-;该电池总反应的离子方程式为2FeO42-+8H2O+3Zn= 2Fe(OH)3+ 3Zn(OH)3+4OH-。(5)在“反应液I ”中加KOH固体的目的有两个。①是与“反应液I”中过量的Cl2继续反应,生成更多的KClO;②是为下一步反应提供反应物。(6)根据反应方程式2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O可知:从“反应液II ”中分离出K2FeO4后,副产品是KNO3和KCl。 2NaOH + H2↑ + Cl2↑。(3)K2FeO4中的Fe+6价,易得电子表现出强氧化性,可杀菌消毒;还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物并可使泥沙聚沉。因此可作为新型多功能水处理剂。(4)K2FeO4 — Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式是FeO42-+3e-+4H2O= Fe(OH)3+5OH-;该电池总反应的离子方程式为2FeO42-+8H2O+3Zn= 2Fe(OH)3+ 3Zn(OH)3+4OH-。(5)在“反应液I ”中加KOH固体的目的有两个。①是与“反应液I”中过量的Cl2继续反应,生成更多的KClO;②是为下一步反应提供反应物。(6)根据反应方程式2Fe(NO3)3 + 2KClO + 10KOH = 2K2FeO4 + 6KNO3 + 3KCl + 5H2O可知:从“反应液II ”中分离出K2FeO4后,副产品是KNO3和KCl。
考点:考查反应条件的选择、物质的制取方法、方程式与电极式的书写等知识。
本题难度:困难
5、选择题 下列说法错误的是
A.K2FeO4能与水作用生成Fe(OH)3胶体和O2,可用于净化自来水并杀菌消毒
B.分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
C.若要除去CO2中含有的少量SO2气体,可通过盛有饱和NaHCO3溶液的洗气瓶
D.对“地沟油’’蒸馏可以获得汽油
|